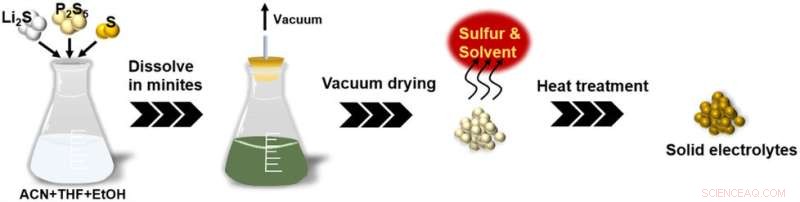
Schémas de la nouvelle technologie de traitement de solution pour les SE de sulfure. Crédit :Université de technologie de Toyohashi
Un groupe de recherche du programme de doctorat du département de génie électrique et électronique de l'Université de technologie de Toyohashi qui comprend un doctorant Hirotada Gamo et le professeur adjoint spécialement nommé Jin Nishida, le professeur agrégé spécialement nommé Atsushi Nagai, le professeur adjoint Kazuhiro Hikima, le professeur Atsunori Matsuda et d'autres, ont développé une technologie de fabrication à grande échelle de Li7 P3 S11 électrolytes solides pour batteries secondaires lithium-ion tout solide.
Cette méthode implique l'ajout d'une quantité excessive de soufre (S) avec Li2 S et P2 S5 , les matières premières du Li7 P3 S11 , à un solvant contenant un mélange d'acétonitrile (ACN), de tétrahydrofuranne (THF) et d'une légère quantité d'éthanol (EtOH). Cela a permis de raccourcir le temps de réaction de 24 heures ou plus à seulement deux minutes. Le produit final obtenu à l'aide de cette méthode est du Li7 très pur P3 S11 sans phase d'impureté qui a montré une conductivité ionique élevée de 1,2 mS cm -1 à 25 °C. Ces résultats nous permettent de produire une grande quantité d'électrolytes solides sulfurés pour les batteries tout solide à faible coût. Les résultats de la recherche ont été publiés en ligne par Advanced Energy and Sustainability Research le 28 avril 2022.
Détails
Les batteries entièrement à semi-conducteurs devraient constituer la prochaine génération de batteries pour véhicules électriques (VE) car elles sont très sûres et permettent une transition vers une densité d'énergie élevée et une puissance de sortie élevée. Les électrolytes solides sulfurés, qui présentent une bonne conductivité ionique et une bonne plasticité, ont été activement développés en vue des applications pour les batteries à semi-conducteurs dans les véhicules électriques. Cependant, aucune technologie de fabrication à grande échelle d'électrolytes solides sulfurés n'a été établie au niveau de la commercialisation, car les électrolytes solides sulfurés sont instables dans l'atmosphère et le processus de synthèse et de traitement nécessite un contrôle atmosphérique. Pour cette raison, il est urgent de développer la technologie de fabrication en phase liquide d'électrolytes solides sulfurés qui offre une évolutivité à faible coût et élevée.
Li7 P3 S11 les électrolytes solides présentent une conductivité ionique élevée et sont donc un électrolyte solide candidat pour les batteries entièrement à l'état solide. La synthèse en phase liquide de Li7 P3 S11 se produit généralement dans un solvant de réaction d'acétonitrile (ACN) via des précurseurs comprenant des composés insolubles. Les processus de réaction conventionnels comme celui-ci prennent beaucoup de temps car ils passent par une réaction cinétiquement désavantageuse d'un matériau de départ insoluble à un intermédiaire insoluble. Pire encore, il est possible que l'intermédiaire insoluble crée une non-uniformité par une formation de phase compliquée, entraînant une augmentation des coûts de fabrication à grande échelle.
Dans ce contexte, le groupe de recherche a travaillé sur le développement d'une technologie de production en phase liquide de Li7 à haute conductivité ionique. P3 S11 électrolytes solides via des solutions précurseurs uniformes. Il a été démontré que la méthode récemment développée peut obtenir une solution de précurseur uniforme contenant du polysulfure de lithium soluble (Li2 Sx ) en seulement deux minutes, en ajoutant Li2 S et P2 S5 , les matières premières du Li7 P3 S11 , et une quantité excessive de S à un solvant contenant un mélange d'ACN, de THF et d'une petite quantité d'EtOH. La clé de la synthèse rapide dans cette méthode est la formation de polysulfure de lithium par l'ajout d'une petite quantité d'EtOH ou d'une quantité excessive de S.
Pour élucider le mécanisme de la réaction dans cette méthode, la spectroscopie ultraviolet-visible (UV-Vis) a été utilisée pour étudier la stabilité chimique de Li2 Sx avec et sans EtOH ajouté. L'étude a montré que la présence d'EtOH rendait Li2 Sx plus stable chimiquement. Ainsi, la réaction dans ce procédé prendrait les étapes suivantes. Premièrement, les ions lithium sont fortement coordonnés avec EtOH, un solvant hautement polaire. Ensuite, protéger les ions polysulfure contre les ions lithium stabilise le S3 hautement réactif ・ - anions radicaux qui sont une sorte de polysulfure. Le S3 généré ・ - attacks the P2 S5, breaking the cage structure of P2 S5 and causing the reaction to progress. The reaction forms lithium thiophosphate which dissolves into a highly soluble mixed solvent containing ACN and THF solvents. This may have helped to obtain uniform precursor solutions very rapidly. The final product, Li7 P3 S11 , could be prepared in two hours without the necessity of ball milling or high energy treatment in the process of reaction.
The ion conductivity of the Li7 P3 S11 obtained using this method was 1.2 mS cm -1 at 25 °C, higher than the Li7 P3 S11 synthesized using the conventional liquid-phase synthesis method (0.8 mS cm -1 ) or ball milling (1.0 mS cm -1 ). The method proposes a new path for the synthesis of a sulfide solid electrolyte and achieves a large-scale manufacturing technology with low cost.
Future Outlook
The research team believes that the low-cost technology for the large-scale manufacturing of sulfide solid electrolytes for all-solid-state batteries proposed in this research could be important in the commercialization of EVs equipped with all-solid-state batteries. The research focused on Li7 P3 S11 for use as a sulfide solid electrolyte. We also want to apply this technology to the synthesis of sulfide solid electrolytes other than Li7 P3 S11 . Solvent effect on liquid-phase synthesis of lithium solid electrolytes