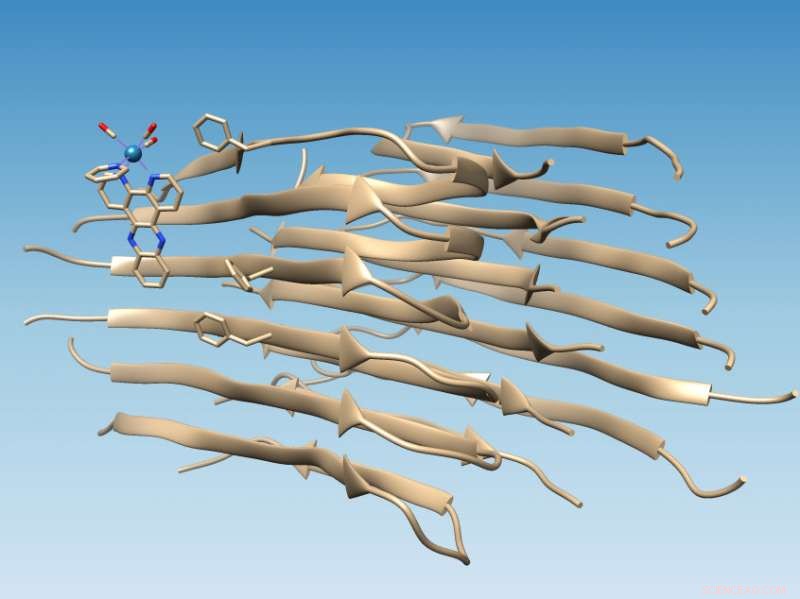
Un complexe à base de rhénium développé à l'Université Rice se lie aux fibrilles du peptide bêta-amyloïde mal replié, qui marque l'emplacement d'une fente hydrophobe qui pourrait servir de cible médicamenteuse, et oxyde la fibrille, ce qui modifie sa chimie d'une manière qui pourrait empêcher une nouvelle agrégation. Crédit : Groupe Martí/Université du riz
Une sonde inventée à l'Université Rice qui s'illumine lorsqu'elle se lie à un peptide bêta-amyloïde mal replié – le genre soupçonné de provoquer la maladie d'Alzheimer – a identifié un site de liaison spécifique sur la protéine qui pourrait faciliter de meilleurs médicaments pour traiter la maladie.
Encore mieux, le laboratoire a découvert que lorsque la sonde métallique est allumée, il catalyse l'oxydation de la protéine d'une manière qui, selon eux, pourrait l'empêcher de s'agréger dans le cerveau des patients.
L'étude réalisée sur de longues fibrilles amyloïdes étaye les simulations informatiques de collègues de l'Université de Miami qui ont prédit que le complexe métallique photoluminescent se fixerait au peptide amyloïde près d'une fente hydrophobe (évitant l'eau) qui apparaît à la surface de l'agrégat de fibrilles. Cette fente présente une nouvelle cible pour les médicaments.
Trouver le site était relativement simple une fois que le laboratoire du chimiste de Rice Angel Martí a utilisé ses complexes à base de rhénium pour cibler les fibrilles. Le complexe de commutation de lumière brille lorsqu'il est touché par la lumière ultraviolette, mais lorsqu'il se lie à la fibrille, il devient plus de 100 fois plus brillant et provoque l'oxydation du peptide amyloïde.
"C'est comme marcher sur la plage, " dit Marti. " Vous pouvez voir que quelqu'un était là avant vous en regardant les traces de pas dans le sable. Bien que nous ne puissions pas voir le complexe du rhénium, nous pouvons trouver l'oxydation (empreinte) qu'il produit sur le peptide amyloïde.
"Cette oxydation ne se produit que juste à côté de l'endroit où elle se lie, " a-t-il dit. " La véritable importance de cette recherche est qu'elle nous permet de voir avec un degré élevé de certitude où les molécules peuvent interagir avec les fibrilles bêta-amyloïdes. "
L'étude paraît dans la revue Chimie .
"Nous pensons que cette fente hydrophobe est un site de liaison général (sur le bêta-amyloïde) pour les molécules, " Martí dit. "C'est important parce que l'agrégation bêta-amyloïde a été associée à l'apparition de la maladie d'Alzheimer. Nous savons que le bêta-amyloïde insoluble fibrillaire est toxique pour les cultures cellulaires. Les oligomères amyloïdes solubles qui sont constitués de plusieurs unités mal repliées de bêta-amyloïde sont également toxiques pour les cellules, probablement encore plus que fibrillaire.
"Il y a un intérêt à trouver des médicaments qui atténuent les effets délétères des agrégats bêta-amyloïdes, " dit-il. " Mais pour créer des médicaments pour ceux-ci, nous devons d'abord savoir comment les médicaments ou les molécules en général peuvent se lier et interagir avec ces fibrilles, et ce n'était pas bien connu. Maintenant, nous avons une meilleure idée de ce dont la molécule a besoin pour interagir avec ces fibrilles."

Une sonde métallique s'illumine lorsqu'elle se lie à un peptide bêta-amyloïde mal replié lors d'une expérience à l'Université Rice. La sonde a identifié un site de liaison qui pourrait faciliter de meilleurs médicaments pour traiter la maladie d'Alzheimer. Crédit :Brandon Martin/Université Rice
Lorsque les peptides amyloïdes se replient correctement, ils cachent leurs résidus hydrophobes tout en exposant leurs résidus hydrophiles (qui attirent l'eau) à l'eau. Cela rend les protéines solubles, dit Marti. Mais quand la bêta-amyloïde se plie mal, il laisse deux résidus hydrophobes, connu sous le nom de Valine 18 et Phénylalanine 20, exposés pour créer la fente hydrophobe.
"C'est parfait, car alors les molécules avec des domaines hydrophobes sont amenées à s'y lier, " dit Martí. "Ils sont compatibles avec cette fente hydrophobe et s'associent à la fibrille, formant une interaction forte."
Si l'oxydation qui en résulte empêche les fibrilles de s'agréger davantage dans la substance collante trouvée dans le cerveau des patients atteints d'Alzheimer, cela peut être le début d'une stratégie utile pour arrêter l'agrégation avant l'apparition des symptômes de la maladie.
"C'est un système très attractif car il utilise la lumière, qui est une ressource bon marché, " dit Martí. " Si nous pouvons modifier les complexes pour qu'ils absorbent la lumière rouge, qui est transparent aux tissus, nous pourrions peut-être effectuer ces modifications photochimiques chez les animaux vivants, et peut-être un jour chez les humains."

De gauche, Le chercheur de l'Université Rice Christopher Pennington, étudiant diplômé Bo Jiang et Angel Martí, professeur agrégé de chimie et de bio-ingénierie, mener une expérience bêta-amyloïde dans le laboratoire Martí. Crédit :Brandon Martin/Université Rice
Il a déclaré que l'activation de la lumière permet aux chercheurs d'avoir un "contrôle exquis" de l'oxydation.
"Nous imaginons qu'il pourrait être possible un jour de prévenir les symptômes de la maladie d'Alzheimer en ciblant la bêta-amyloïde de la même manière que nous traitons le cholestérol chez les gens maintenant pour prévenir les maladies cardiovasculaires, " dit Martí. " Ce serait merveilleux. "