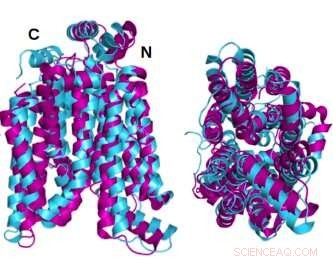
Deux angles de la protéine de transport de glucose à structure cristalline GLUT1 (magenta) superposés à la variante soluble dans l'eau prédite par ordinateur AlphaFold2 de la même protéine (cyan) démontrent que la protéine cristalline et sa variante QTY soluble dans l'eau partagent une similitude structurelle remarquable. Crédit :Laboratoire Shuguang Zhang, MIT
Toutes les membranes cellulaires du corps humain contiennent des protéines intégrées qui servent de capteurs, de messagers ou de moyen de transport et de régulation des substances entrant et sortant de la cellule. Les protéines de transport en particulier sont mal connues en raison de leur complexité structurale et de leur nature hydrophobe qui les rend résistantes à l'étude. Parallèlement, ces protéines de transport, notamment celles qui régulent le glucose, jouent un rôle essentiel dans la croissance des tumeurs cancéreuses.
Dans une nouvelle étude, des scientifiques dirigés par le Dr Shuguang Zhang, Ph.D. du MIT Media Lab, démontrent une méthode pour prédire rapidement la conception de structures variantes hydrophiles des 14 protéines membranaires de transport du glucose dans les cellules. Cela permettra aux chercheurs d'étudier plus facilement les protéines dans l'eau. Les scientifiques confirment l'exactitude des structures prédites en les comparant à des images cristallographiques préexistantes de deux des protéines.
Ils espèrent qu'une meilleure compréhension de ces protéines de transport du glucose accélérera le développement d'anticorps monoclonaux thérapeutiques pour traiter les métastases cancéreuses. Cela affamerait essentiellement les cellules cancéreuses en bloquant les transporteurs de glucose.
"La plupart des cellules cancéreuses augmentent considérablement leur expression et leur production de transporteurs de glucose, appelés GLUT, pour leur demande énergétique insatiable", explique Eva Smorodina, étudiante stagiaire de premier cycle en biologie structurale au Greiff Lab, Université d'Oslo, qui est le premier auteur de un article sur l'étude publié le 27 juin dans QRB Discovery . "Actuellement, il n'y a presque pas de médicaments efficaces pour bloquer les GLUT, car ils ont une structure difficile."
Les structures complexes des GLUT comprennent 12 hélices hydrophobes transmembranaires intégrées dans la membrane. Dans leur état natif ou cristallin, les structures hydrophobes doivent être placées dans un détergent ou un réactif spécial pour une étude en laboratoire, sinon elles perdent leur structure. Et avec les protéines, la structure et la fonction sont liées de manière indélébile.
« Étudier ces protéines dans un détergent, c'est comme porter des gants épais pour assembler une montre coûteuse ou jouer du violon », explique le Dr Zhang, l'un des rares scientifiques biomédicaux pour qui l'étude des protéines membranaires est aussi convaincante qu'elle est vitale pour notre compréhension. de cellules cancéreuses. Il a commencé à travailler sur les protéines membranaires au début des années 2000. "Peu de gens étudiaient ces protéines membranaires", explique le Dr Zhang. "Ils sont comme une patate chaude", dit-il, en raison de leur résistance inhérente à l'étude.
Le nouveau travail est basé sur le succès du Dr Zhang il y a quatre ans, lorsque lui et une équipe ont accompli ce sur quoi le Dr Zhang travaillait depuis près d'une décennie :ils ont conçu une méthode magnifiquement simple appelée le code QTY pour transformer une protéine hydrophobe de la membrane cellulaire. en une protéine hydrophile en substituant de nombreux acides aminés hydrophobes.
Le code QTY est nommé pour les symboles des trois acides aminés - glutamine (Q), thréonine (T) et tyrosine (Y) - qui remplacent quatre acides aminés hydrophobes :leucine (L), isoleucine (I), valine ( V) et la phénylalanine (F). Aucun de ces acides aminés ne porte de charge, ce qui rend la substitution bénigne. La structure est essentielle au fonctionnement des protéines, et la substitution ne modifie pas la structure.
Dans la dernière étude, le Dr Zhang et son équipe appliquent le code QTY aux 14 protéines membranaires de transport du glucose qui transportent le sucre vers les cellules. Ils ont utilisé le nouveau programme AlphaFold2, un programme de calcul basé sur l'intelligence artificielle développé par la société DeepMind, qui peut prédire avec précision et rapidement comment les protéines se replient. Le Dr Zhang et son équipe ont utilisé le code QTY avec l'AlphaFold2 open source pour prédire les formes alpha hélicoïdales des 14 protéines GLUT dans leurs formes hydrophobes naturelles et leurs formes solubles dans l'eau modifiées par le code QTY.
Les structures cristallines ou à l'état natif de deux des GLUT - 1 et 3 - avaient été révélées précédemment par d'autres chercheurs utilisant la cristallographie aux rayons X. Pour étayer leur propre méthodologie, l'équipe du Dr Zhang a d'abord prédit la structure hydrophile de ces deux GLUT en appliquant les remplacements d'acides aminés du code QTY et en laissant AlphaFold2 prédire les formes des protéines. Il l'a fait avec une grande précision. Les images hydrophobes et hydrophiles superposées sont presque identiques.
L'équipe a suivi cette confirmation en combinant le code QTY et AlphaFold2 pour prédire les structures hydrophiles des 12 autres GLUT, en un temps record. "En 2018, il a fallu quatre à cinq semaines à l'aide d'un cluster d'ordinateurs à grande vitesse pour simuler n'importe quelle structure protéique", explique le Dr Zhang. "Maintenant, avec AlphaFold2, nous pouvons utiliser un ordinateur Google gratuitement, et il simule les protéines transmembranaires en quelques heures. Certaines petites protéines ont pris moins d'une heure."
"Cette étude sur les transporteurs de glucose membranaires humains et leurs variantes QTY solubles dans l'eau du laboratoire Zhang du MIT est fascinante", déclare le professeur Joel Sussman de l'Institut Weizmann des sciences à Rehovot, en Israël, qui n'a pas participé aux travaux. "Il fournit une visualisation expérimentale via la cristallographie aux rayons X et la prédiction de l'IA à l'aide d'AlphaFold2 pour voir, pour la première fois, à une résolution atomique, les différences entre les hélices hydrophobes" qui détestent l'eau "et les hélices hydrophiles" qui aiment l'eau ". étape dans l'utilisation de la méthode du code QTY pour étudier les protéines transmembranaires multispan et d'autres protéines agrégées à travers leurs variantes solubles dans l'eau, et est susceptible d'avoir un impact énorme dans le domaine de la biotechnologie.
Le professeur Robert Langer du MIT, dont les travaux en génie biomédical sont très appréciés, déclare :"La [découverte du QRB ] est excellent et je pense qu'il a le potentiel d'aider de nombreux patients atteints de cancer." Le professeur Langer n'a pas participé à la recherche.
Auteurs de la Découverte QRB papier sont le Dr Zhang et Smorodina; Fei Tao et Rui Qing de l'Université Jiaotong de Shanghai (le Dr Qing était auparavant chercheur postdoctoral au MIT Media Lab et plus tard chercheur scientifique à l'Institut Koch pour la recherche intégrative sur le cancer au MIT); le Dr Steve Yang, ancien élève du MIT maintenant à PT Metiska Farma en Indonésie; et le Dr David Jin, M.D., Ph.D. d'Avalon GloboCare Corp., qui a incité le Dr Zhang à appliquer le code QTY à l'étude des cellules cancéreuses. Avalon GloboCare a également financé la recherche.
Le Dr Jin dit qu'il espère, mais cela ne fait pas partie de l'étude actuelle, que les recherches futures pourront modifier génétiquement les membranes de passage du glucose pour développer de nouvelles cibles thérapeutiques.
"Maintenant, nos seuls choix pour le traitement du cancer sont la chirurgie, la chimiothérapie ou la thérapie par petites molécules", explique le Dr Jin. "À l'avenir, il sera peut-être possible de prendre la cellule T d'un patient, un composant du système immunitaire, et de la modifier génétiquement en laboratoire afin qu'elle puisse fonctionner presque comme un système GPS de recherche du cancer avec une capacité d'attaque des tumeurs. " Les scientifiques modifient les protéines membranaires pour les rendre plus faciles à étudier