Des chercheurs de l'Université des sciences de Tokyo ont développé de nouveaux hybrides de peptides complexes, qui peuvent induire un type de mort cellulaire programmée appelée "paraptose" dans les cellules cancéreuses résistantes à l'apoptose. Crédit :Université des sciences de Tokyo
L'apoptose, un type de mort cellulaire programmée (PCD), est un processus biologique par lequel les cellules indésirables sont éliminées dans les organismes multicellulaires. Dans la plupart des cellules, certaines protéines appelées "caspases" déclenchent l'apoptose. Ce processus est particulièrement important pour le traitement du cancer, car l'induction de la mort cellulaire dans les cellules cancéreuses peut aider à leur élimination.
Outre l'apoptose, plusieurs types de PCD se produisent dans les cellules, notamment la paraptose, la nécroptose et l'autophagie. Parmi celles-ci, la paraptose est le type de PCD le plus récemment identifié, qui est causé par l'afflux de calcium en excès dans les cellules, entraînant la mort cellulaire.
Les cellules cancéreuses deviennent souvent résistantes aux médicaments qui induisent l'apoptose et à d'autres types de PCD. Dans de tels cas, induire une paraptose, qui ne dépend pas des caspases, pourrait constituer un traitement anticancéreux prometteur. Par conséquent, le développement de composés pouvant induire une paraptose dans les cellules cancéreuses est crucial.
À cette fin, une équipe de chercheurs de l'Université des sciences de Tokyo, dirigée par le professeur Shin Aoki en collaboration avec M. Kohei Yamaguchi et le Dr Kenta Yokoi, a mené une étude pour développer de nouveaux hybrides de peptides complexes avec un potentiel inducteur de paraptose. Cette étude a été publiée dans Bioconjugate Chemistry .
"Auparavant, nous avons synthétisé un composé hybride complexe-peptide d'iridium et observé qu'il induisait la mort cellulaire dans les cellules cancéreuses, ce qui était différent de l'apoptose. Étant donné que ce composé était différent des autres composés induisant la paraptose, nous voulions comprendre son mécanisme d'induction de la paraptose. Notre objectif est maintenant de synthétiser de nouveaux composés et d'élucider comment ils induisent la paraptose dans les cellules, avant de partager cette information cruciale avec le public », explique le professeur Aoki tout en discutant de la motivation de l'équipe derrière cette étude.
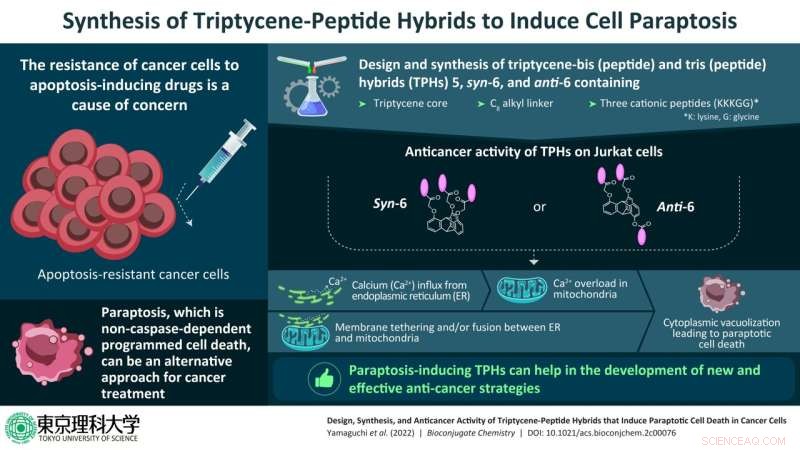
Les composés nouvellement synthétisés étaient composés d'un noyau triptycène - un hydrocarbure aromatique - avec deux ou trois peptides cationiques constitués des acides aminés lysine et glycine (représentés par KKKGG) via un C8 chaîne de liaison alkyle, à différentes positions des unités triptycènes. En conséquence, trois hybrides triptycènes (TPH) ont été produits, à savoir 5, syn-6 et anti-6.
L'équipe a ensuite réalisé des expériences sur des cellules Jurkat, un type de lymphocytes humains immortalisés utilisés dans la recherche, pour comprendre le type de PCD qui s'est produit dans ces cellules lors d'un traitement avec syn-6 et anti-6. Ils ont découvert que la mort dans ces cellules était inhibée par le cyanure de carbonyle m-chlorophényl hydrazone (CCCP) qui est un réactif de découplage et un inhibiteur de l'absorption du calcium mitochondrial, RuRed, qui est un inhibiteur du canal calcique mitochondrial), et le borate de 2-aminoéthoxydiphényle. (2-APB), qui est un inhibiteur du récepteur D-inositol-1,4,5-trisphosphate. Cependant, la mort cellulaire n'a pas été inhibée par les inhibiteurs des autres types de PCD.
Par conséquent, ils ont exclu l'autophagie, la nécroptose et l'apoptose, confirmant que la paraptose est une voie majeure de la PCD induite par syn-6 et anti-6 dans les cellules Jurkat.
"Des études ont indiqué que les TPH syn-6 et anti-6 induisent le transfert de l'excès de calcium du réticulum endoplasmique (ER) vers les mitochondries, entraînant une perte de potentiel membranaire mitochondrial. Il est très probable que ces phénomènes soient fortement liés à la fusion du RE avec les mitochondries, suivie d'une vacuolisation cytoplasmique, entraînant la mort cellulaire », a déclaré le professeur Aoki, lorsqu'on lui a demandé pourquoi ces deux TPH avaient été sélectionnés pour l'étude. Les TPH syn-6 et anti-6 sont plus hydrophiles que les autres TPH, ce qui pourrait également expliquer leur fort potentiel anticancéreux induisant une paraptose.
Grâce à des expériences d'imagerie supplémentaires, l'équipe a détecté la présence d'une vacuolisation cytoplasmique, des concentrations élevées de calcium mitochondrial et la dégradation du RE dans les cellules Jurkat traitées avec syn-6 et anti-6.
Sur la base de découvertes précédentes, l'équipe a émis l'hypothèse que dans les cellules Jurkat également, l'afflux de calcium dans les mitochondries pourrait être facilité par la proximité du RE et des mitochondries. Comme prévu, ils ont découvert que les membranes du RE et des mitochondries étaient attachées l'une à l'autre, facilitant le transfert direct du calcium.
Ces résultats ont confirmé que les cellules Jurkat traitées avec syn-6 et anti-6 avaient subi une mort cellulaire programmée, due à la paraptose. Ils fournissent également des informations cruciales pour la conception de composés pouvant être utilisés comme agents thérapeutiques contre le cancer et d'autres maladies. Un métallopeptide cible et perturbe la fonction mitochondriale dans les cellules souches du cancer du sein