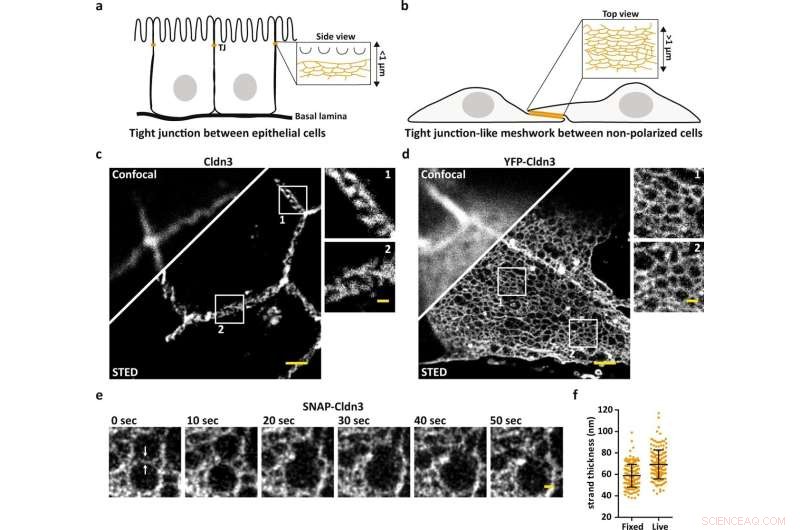
La microscopie STED révèle l'organisation à l'échelle nanométrique des réseaux TJ. un schéma illustrant le TJ endogène au contact cellule à cellule le plus apical dans les cellules épithéliales. b Schéma illustrant un maillage de type TJ formé dans des zones plates se chevauchant de cellules non polarisées transfectées par la claudine. c, d Image confocale et STED représentative d'un TJ formé endogène marqué pour Cldn3 (2nd-Atto647N) entre les cellules épithéliales du tissu du duodénum de souris (c) et le maillage de type TJ formé par YFP-Cldn3 surexprimé (α-GFP-NB- Atto647N) entre deux cellules COS-7 (d). e Série chronologique STED représentative d'une seule couleur (1 image/10 s) d'un maillage de type TJ dans une région chevauchante de cellules COS-7 vivantes exprimant SNAP-Cldn3 (BG-JF646). Les flèches blanches indiquent la rupture initiale du brin suivie de la fusion de deux mailles plus petites en une maille plus grande. Un flou gaussien avec un sigma de 20 nm a été appliqué. f Mesure pleine largeur demi-maximale (FWHM) des brins TJ de SNAP-Cldn3 (BG-JF646) dans des cellules COS-7 fixes et vivantes. Les données représentent la moyenne ± SD. Chaque point de données représente un profil de ligne sur un total de 160 profils de ligne à partir de 8 maillages indépendants de type TJ (n = 160). La FWHM globale a donné 59 ± 11 nm pour les échantillons fixes et 69 ± 14 nm pour les échantillons vivants. Toutes les images représentatives proviennent de 3 expériences indépendantes. Barres d'échelle, 1 µm (c, d) et 200 nm (grossissements en c, d et e). Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-32533-4
Elles scellent les cellules épithéliales et, sous certaines conditions, permettent le passage des ions et de l'eau :Les jonctions serrées forment une barrière paracellulaire dans les tissus et leur dysfonctionnement est associé à des maladies. Bien que leurs composants moléculaires soient connus depuis les années 1990, l'organisation des 26 protéines appelées claudines n'est pas claire.
Les scientifiques du Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) ont maintenant acquis des connaissances approfondies sur la structure des jonctions serrées, en utilisant la microscopie à super-résolution par émission stimulée (STED). C'est la première fois que le mécanisme de base sous-tendant toutes les propriétés de la barrière épithéliale est décrit.
Les jonctions serrées (TJ) sont normalement excellentes pour permettre le passage des ions ou des molécules nécessaires, tout en formant une barrière dense pour empêcher les bactéries indésirables et leurs toxines de pénétrer dans le corps. Ces barrières paracellulaires, qui peuvent être à la fois des canaux sélectifs pour les ions et l'eau, se trouvent partout où les cellules épithéliales ou les cellules endothéliales se rencontrent, c'est-à-dire là où différents tissus sont connectés les uns aux autres ou lorsque la lumière d'un organe doit être isolée de la circulation sanguine.
L'existence des jonctions serrées a été découverte il y a une soixantaine d'années, et leurs principaux composants moléculaires sont connus depuis 30 ans :26 protéines membranaires appelées claudines. Selon les cellules, les claudines s'organisent en différentes constellations pour former des maillages semi-perméables pouvant atteindre plusieurs centaines de nanomètres de large. Habituellement, plusieurs claudines se rejoignent, mais certaines barrières ne sont constituées que d'une ou deux protéines structurelles.
Mais la question est de savoir comment les claudines s'organisent pour créer des propriétés barrières différentes selon la cellule ou le tissu en question ? Et, dans quelle mesure les claudins dépendent-ils les uns des autres dans le processus ? Jusqu'à présent, ces questions restaient sans réponse car il était impossible de voir à travers la structure des brins, qui ne font qu'une dizaine de nanomètres d'épaisseur. Aujourd'hui, les scientifiques du FMP ont réussi à faire exactement cela en utilisant la microscopie STED.
"Ce type de microscopie à super-résolution et une excellente équipe de biologistes cellulaires, d'informaticiens et de physiologistes nous ont aidés à faire la lumière sur l'architecture moléculaire des jonctions serrées", a déclaré le Dr Martin Lehmann, chef du Cellular Imaging Group, dernier auteur de l'étude. "Nous avons maintenant pu pour la première fois décrire le mécanisme sous-jacent aux principales propriétés de barrière épithéliale."
Utilisation de STED pour résoudre des maillages uniques
Normalement, la résolution des microscopes à fluorescence est limitée à environ 250 nanomètres. En utilisant la microscopie STED, 50 nanomètres ou moins sont possibles. Cela a littéralement donné aux chercheurs une plus grande perspicacité.
"Avec la microscopie à fluorescence standard, nous n'aurions jamais pénétré l'organisation dense de la jonction serrée, mais STED nous a permis de résoudre les mailles individuelles du réseau. En conséquence, nous sommes maintenant en mesure de déterminer la position exacte des protéines, comme ainsi que pour voir si les claudins se mélangent ou se séparent, et comment ils se séparent », déclare Hannes Gonschior, le premier auteur de l'étude, qui a mené son doctorat. thèse sur le sujet à la FMP. "Cette organisation à l'échelle nanométrique était auparavant inconnue."
Dans un premier temps, les études ont été menées au niveau cellulaire, puis dans les tissus intestinaux et rénaux de souris. Des images frappantes reproduisaient les protéines marquées par fluorescence dans différentes couleurs, montrant où se trouvaient les protéines et comment elles s'enchaînent pour former une fermeture éclair colorée.
Trois résultats de l'étude, désormais publiés dans Nature Communications , sont particulièrement remarquables :
Création d'un modèle pour la découverte de médicaments
Le fait que les chercheurs du FMP aient pu pour la première fois déterminer l'organisation à l'échelle nanométrique des jonctions serrées est un succès majeur pour la recherche fondamentale. Mais la médecine peut également bénéficier de la percée. En effet, les mutations des claudines jouent un rôle dans un certain nombre de maladies héréditaires, la plus évidente étant le syndrome HELIX, une maladie rare entraînant une réduction de la production de sueur.
Une mutation de la claudine 10b est le coupable, provoquant une hypohidrose et des anomalies des glandes lacrymales et salivaires, ainsi qu'une altération de la régulation du calcium et du magnésium dans les reins. L'équipe de chercheurs avait également expérimenté ce mutant de la maladie.
"Notre recherche est encore loin d'avoir une pertinence clinique", a déclaré le biophysicien Martin Lehmann, évaluant leurs découvertes. "Mais au moins maintenant, nous comprenons comment ces maillages sont structurés. C'est la première étape, qui nous permettra de rechercher de petites molécules qui ouvrent ou ferment ces barrières."
Le biologiste cellulaire Hannes Gonschior a ajouté qu'ils "ont trouvé un modèle simplifié pour la découverte de médicaments et, plus généralement, ont mené des recherches sur le passage paracellulaire des ions. Il est très probable que nos découvertes nous permettront de comprendre des phénotypes cliniques et des symptômes jusque-là inexpliqués - avec un défaut dans l'une de ces barrières paracellulaires particulières." Combler l'écart :un mécanisme à deux niveaux pour la barrière épithéliale