Crédit :Université de l'Oregon
Les scientifiques savent depuis des décennies qu'une certaine classe d'enzymes est un acteur important de la biologie cellulaire, car elles mutent fréquemment et deviennent des moteurs majeurs du cancer.
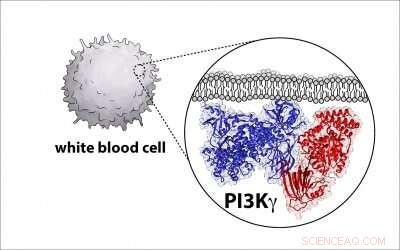
Les sociétés biopharmaceutiques tentent de développer des médicaments qui ciblent et inactivent ces enzymes, connu sous le nom de phosphoinositide 3-kinase, ou PI3K pour faire court, en raison de leur rôle dans l'apparition de cancers chez l'homme. Mais pour faire ça, les scientifiques ont besoin d'un plan détaillé de l'architecture enzymatique, et le professeur de biochimie de l'UO Scott Hansen fait partie d'un groupe qui découvre ce diagramme.
Hansen, professeur adjoint au département de chimie et biochimie de l'UO, ladite partie du défi est que les molécules sont complexes, avec deux grosses protéines qui se réunissent et forment un complexe.
"Il est donc très difficile de comprendre quelle est la structure et l'organisation de cette protéine, " at-il dit. " Une condition préalable au développement d'un médicament est d'apprendre comment le médicament se lie à la molécule. Vous avez besoin d'un plan de la protéine sur laquelle ancrer ce médicament."
Maintenant, Hansen et ses collègues de plusieurs autres universités ont développé un tel modèle pour PI3K et identifié où une protéine régulatrice critique se lie à l'enzyme, une découverte susceptible d'aider à stimuler les efforts visant à créer des médicaments anticancéreux plus spécifiques.
« Cela va certainement façonner la façon dont les gens envisagent de développer des thérapies contre le cancer, " il a dit.
Hansen est l'un des 13 co-auteurs de l'article publié dans la revue Avancées scientifiques , avec des collègues des universités de Victoria, Colombie britannique, Washington et Genève, et Vrije Universiteit Brussel en Belgique.
Ce qui rend l'article unique, ce sont "des informations structurelles à plus haute résolution et la possibilité de mesurer les interactions biologiquement pertinentes avec d'autres molécules en définissant la séquence et la priorité des interactions, " a déclaré Hansen.
Mais il a déclaré qu'il restait beaucoup de travail à faire pour mieux comprendre comment d'autres molécules se lient à la protéine et modulent sa fonction.
Pour connaître la structure de l'enzyme, les chercheurs ont utilisé une technique appelée cryomicroscopie électronique, qui recueille des dizaines de milliers d'images d'enzymes P13K uniques dans une couche de glace ultra-mince à l'aide d'un microscope électronique. Les images sont compilées et moyennées pour créer une seule image haute résolution qui révèle les caractéristiques structurelles de l'enzyme.
Dans ce cas, la structure de l'enzyme était différente de ce que l'on pensait auparavant. Le nouveau plan permettra aux chercheurs de définir comment d'autres molécules activent la protéine.
"Souvent, nous faisons des recherches et nous obtenons des indices sur la façon dont les protéines sont organisées ou nous examinons les structures de molécules apparentées et extrapolons, mais parfois ces hypothèses sont inexactes et peuvent conduire un champ sur la mauvaise voie, " a déclaré Hansen. " Le fait d'avoir une résolution plus élevée de l'organisation des molécules permet aux gens de développer des médicaments spécifiques à cette molécule uniquement. "
Hansen a déclaré que les chercheurs impliqués dans le document ont passé 10 ans à travailler sur le problème.
"Ce n'est pas rare pour de vraies protéines compliquées, " il a dit.
Hansen a déclaré que son laboratoire à l'UO et le laboratoire de John Burke à l'Université de la Colombie-Britannique mènent des recherches complémentaires. Le laboratoire de Burke utilise la cryomicroscopie électronique pour obtenir des images haute résolution des molécules, et le laboratoire de Hansen est capable de "faire des mesures plus dynamiques qui nous permettent de mesurer les interactions de cette enzyme et d'autres facteurs essentiels à l'activation".
Il a dit que c'était excitant de collaborer avec d'autres scientifiques qui ont une expertise dans des domaines qu'il n'a pas.
"De plus en plus, pour que nous puissions réaliser nos ambitions de recherche, nous ne pouvons pas nous fier uniquement aux compétences de notre propre laboratoire, ", a-t-il déclaré. "Les problèmes deviennent trop compliqués et vous devez les aborder sous différents angles et intégrer beaucoup d'expertises différentes."