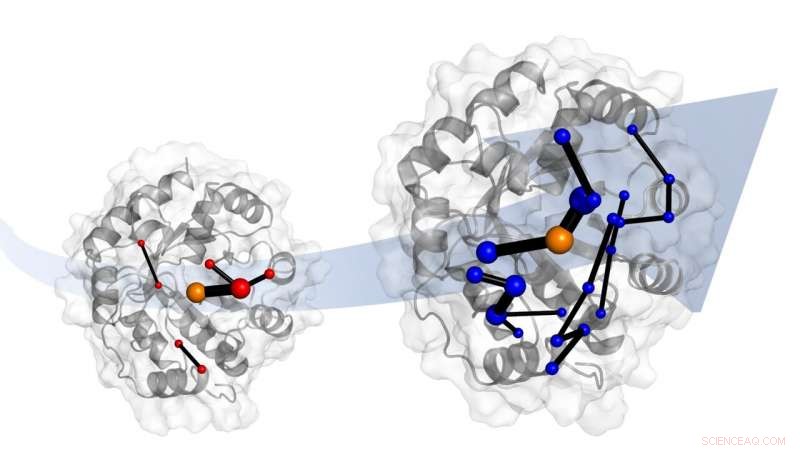
L'évolution en laboratoire d'une enzyme de conception en fait un bien meilleur catalyseur. Les simulations montrent que l'évolution le fait en introduisant des réseaux d'acides aminés. Ces réseaux promettent d'être des modèles pour la conception de catalyseurs. Crédit :Dr Adrian Bunzel
Des chercheurs de l'Université de Bristol ont montré comment l'évolution en laboratoire peut donner naissance à des enzymes hautement efficaces pour des réactions inédites, ouvrant la porte à des moyens nouveaux et plus respectueux de l'environnement de fabriquer des médicaments et d'autres produits chimiques.
Les scientifiques ont déjà conçu des catalyseurs de protéines à partir de zéro à l'aide d'ordinateurs, mais ceux-ci sont beaucoup moins capables que les enzymes naturelles. Pour améliorer leurs performances, une technique appelée évolution en laboratoire peut être utilisée, dont l'ingénieure chimiste américaine Frances Arnold a été pionnière et pour laquelle elle a reçu le prix Nobel en 2018. L'évolution dirigée imite la sélection naturelle, permettant aux scientifiques d'utiliser la puissance de la biologie pour améliorer la capacité des protéines à effectuer des tâches telles que la catalyse d'une réaction chimique spécifique.
Mais bien que l'équipe de recherche ait récemment utilisé l'évolution en laboratoire pour améliorer une enzyme conçue de plus de 1, 000 fois, on ne savait pas comment l'évolution stimule son activité. Jusqu'à maintenant.
L'auteur principal, le professeur Adrian Mulholland de l'école de chimie de Bristol, a déclaré :« L'évolution peut rendre les catalyseurs beaucoup plus actifs. l'évolution fonctionne de manière mystérieuse :par exemple, les mutations qui améliorent apparemment la catalyse impliquent souvent des changements dans les acides aminés loin du site actif où la réaction se produit. »
"Nous voulions comprendre comment l'évolution peut transformer des biocatalyseurs de conception inefficaces en enzymes hautement actives.", le premier auteur de l'étude, Dr Adrian Bunzel, mentionné.
Faire cela, l'équipe de recherche internationale de Bristol, l'ETH Zurich et l'Université de Waikato (NZ) se sont tournés vers les simulations moléculaires par ordinateur. "Ceux-ci montrent que l'évolution change la façon dont la protéine se déplace - sa dynamique. En termes simples, l'évolution « règle » la flexibilité de la protéine entière, " il ajouta.
L'équipe a également identifié le réseau d'acides aminés dans la protéine responsable de ce « réglage ». Ces réseaux impliquent des parties de la protéine qui sont modifiées par l'évolution.
Le Dr Bunzel a dit :« Après l'évolution, la protéine entière semble travailler ensemble pour accélérer la réaction. Ceci est important car lorsque nous concevons des enzymes, nous nous concentrons souvent uniquement sur le site actif uniquement, et oubliez le reste de la protéine."
Le professeur Mulholland a ajouté :« Ce type d'analyse pourrait aider à concevoir des enzymes « de novo » plus efficaces, pour des réactions qu'auparavant nous ne pouvions pas cibler."
La recherche, Publié dans Chimie de la nature , révèle comment l'évolution rend les enzymes de conception plus puissantes, ouvrant la voie à des catalyseurs sur mesure pour la chimie verte.
Les chercheurs vont maintenant utiliser leurs découvertes pour aider à concevoir de nouveaux catalyseurs protéiques.