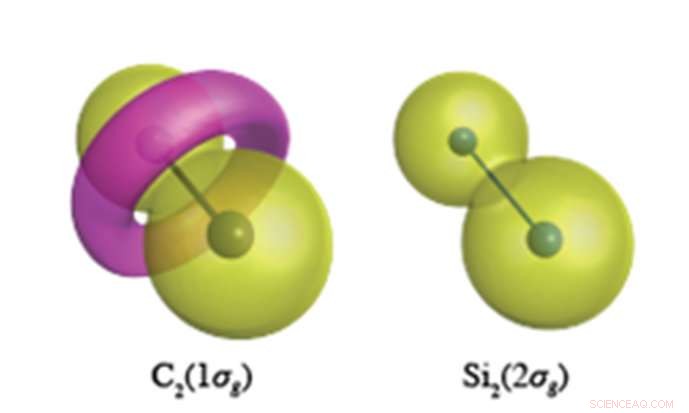
On s'attend à ce que les électrons du noyau interne aient une fonction d'onde semblable à celle d'une cacahuète, comme le montre le Si
Les chercheurs de YNU ont résolu le mystère séculaire de la raison pour laquelle le silicium ne peut pas remplacer le carbone dans les composés organiques. Un nouveau calcul de référence en chimie quantique de C
Depuis la découverte du silicium et le succès de Wöhler au milieu du 19e siècle avec la synthèse de composés organiques, Wöhler lui-même a été parmi les premiers à suggérer de remplacer le carbone par du silicium dans les composés organiques. Il est devenu clair au début du 20e siècle que le silicium n'a pas une chimie similaire au carbone, et les rêves de vie à base de silicium ne survivent que dans la science-fiction. Nous savons empiriquement que le carbone a la capacité de former une variété de composés insaturés, ce que le silicium ne fait pas. Cependant, la cause profonde de la raison pour laquelle seul le carbone a cette capacité est restée un mystère.
Des calculs de chimie quantique d'une précision sans précédent effectués à YNU révèlent que les électrons du noyau (qui n'étaient pas censés participer à la liaison chimique) ont un rôle très différent dans les composés insaturés du carbone et du silicium. Le carbone a la propension à modifier la topologie (structure nodale) de ses électrons de noyau, lequel, pour C
L'impact de cette découverte est considérable. Les électrons du noyau ont jusqu'à présent été supposés plus ou moins inertes, mais peut-être devient-il nécessaire de réévaluer leur contribution à la liaison chimique, au moins dans le cas des liaisons insaturées. Finalement, l'étude suggère que d'autres éléments, comme l'azote, phosphoreux, et le fluor, présentent une flexibilité similaire pour modifier leurs topologies électroniques de cœur, Et ainsi, présentent des chimies tout aussi riches.
Le papier, "Topologies d'électrons de base dans les composés chimiques :étude de cas du carbone par rapport au silicium, " est publié dans Angewandte Chemie Édition Internationale vol 57(24) le 6 juin, 2018.