Crédit :Université RUDN
Un chimiste de l'Université RUDN a découvert quatre nouveaux composés stables qui peuvent être obtenus dans la réaction de l'iode avec l'iodure de méthylammonium. L'utilisation de ces substances permettra la production de panneaux solaires à pérovskite sans réactifs toxiques et évitera les sous-produits lors de la fabrication. L'article est publié dans Le Journal des lettres de chimie physique .
Les pérovskites hybrides à base de plomb sont utilisées dans les cellules solaires modernes en tant que couche absorbant la lumière. Mais ils sont instables à l'humidité, et les technologies existantes nécessitent l'utilisation de solutions et de solvants toxiques. Cela complique la technologie et la rend potentiellement dangereuse.
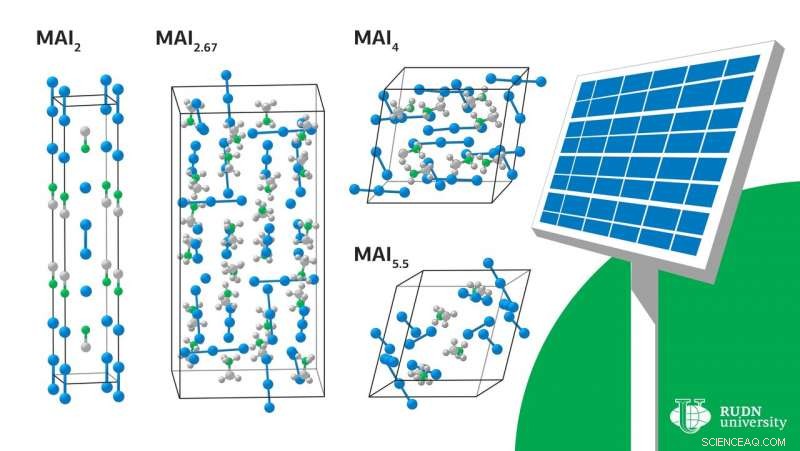
La solution au problème pourrait être des méthodes sans solvant, C'est, l'utilisation de masses fondues plutôt que de solutions - par exemple, appliquer une masse fondue de polyiodure à un film mince de plomb métallique. Cependant, il existe peu d'études fiables sur la chimie des polyiodures. Les chercheurs ont étudié les propriétés du méthylammonium (CH
Les composés du système d'iodure de méthylammonium (MA) et d'iode fondent à température ambiante et forment des liquides ioniques, des fontes composées exclusivement d'ions. Ces liquides précurseurs peuvent être appliqués uniformément sur de grandes surfaces, portant la production industrielle de cellules solaires modulaires à base de pérovskites hybrides pour le marché commercial.
Les liquides à base de polyiodures ne fondent à température ambiante qu'en présence de gros cations organiques dans la composition. Le chimiste de l'Université RUDN Victor Khrustalev a expliqué cette différence par le fait que le cation méthylammonium a un grand moment dipolaire et est capable de former un grand nombre de liaisons hydrogène. Aux petites tailles de cations, cela conduit à une augmentation de l'entropie lors de la fusion, ce qui abaisse la température de fusion.
Sous certaines conditions, des cristaux de diverses compositions commencent à évoluer hors du liquide-MAI
Ces données thermodynamiques nous ont permis de définir et de généraliser les valeurs expérimentales des limites dans lesquelles le bain peut exister.
Les chimistes ont également découvert que de tels effets se produisent dans des composés similaires avec le cation formamidine (FA
+
=HC(NH