Un commutateur dépendant du potentiel facilite la séparation de l'eau à l'aide de catalyseurs à base d'oxyde de cobalt, Des chercheurs du Boston College et de l'Université de Yale rapportent dans la revue Chem. Une petite charge électrique entraîne une réaction de dégagement d'oxygène qui utilise de l'eau pour produire de l'hydrogène gazeux. Crédit: Chimie
En utilisant du cobalt abondant et une approche expérimentale unique pour sonder les moyens d'accélérer une réaction catalytique lente pour récupérer l'hydrogène de l'eau, des chercheurs du Boston College et de l'Université de Yale ont découvert un interrupteur mécanique dans la réaction de dégagement d'oxygène, une étape importante vers l'optimisation des électrocatalyseurs pour la séparation de l'eau afin de produire de l'énergie propre.
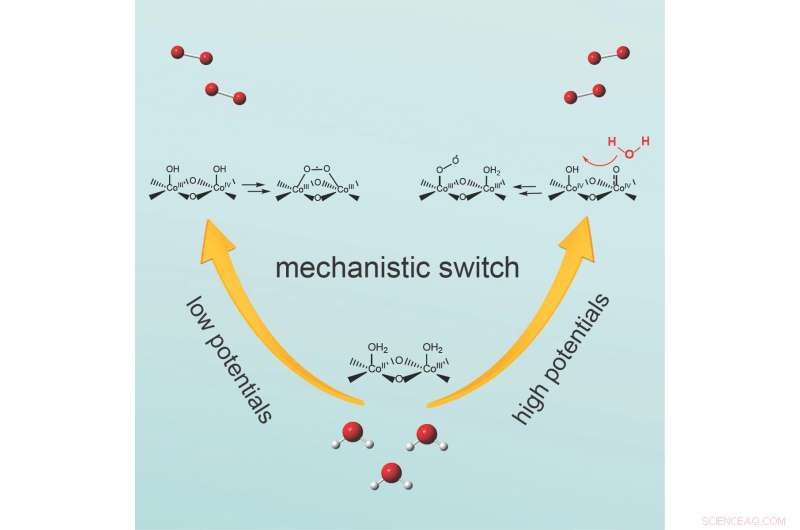
Le mécanisme commute en faisant varier la quantité de tension, ou potentiel appliqué, l'équipe rapporte dans le journal Chimie . A potentiel modéré, deux atomes d'oxygène liés à la surface du catalyseur réagissent pour former la liaison oxygène-oxygène. Par contre, à des potentiels plus élevés, la liaison oxygène-oxygène est formée par une molécule d'eau attaquant une espèce d'oxygène liée à la surface.
Les résultats montrent que dans cette classe de matériaux, un électrocatalyseur pour cette réaction doit être choisi, ou optimisé, en fonction du régime potentiel dans lequel il est prévu de fonctionner dans un réacteur. En d'autres termes, un catalyseur donné peut être particulièrement efficace pour promouvoir un mécanisme, mais pas l'autre.
« Ce qui nous a surpris, c'est la rapidité avec laquelle le passage d'un régime mécanique à un autre avec un potentiel appliqué se produit, " a déclaré Dunwei Wang, professeur de chimie au Boston College, un auteur principal du rapport. "Seulement environ 100 mV sont nécessaires pour basculer entre les deux mécanismes. C'est un rappel de la sensibilité des mécanismes de réaction. Plus largement, le commutateur facile peut être une autre indication de la façon dont la photosynthèse peut s'adapter aux changements de l'environnement de réaction pour des performances optimisées."
Les chercheurs ont travaillé pour diviser l'eau en hydrogène moléculaire et en oxygène dans le but de fournir une énergie renouvelable abondante sous la forme d'hydrogène gazeux transportable et stockable. La séparation peut être réalisée par électrocatalyse, un processus dans lequel les réactions de dégagement d'hydrogène et d'oxygène se produisent dans des compartiments spatialement séparés sur des électrodes. Cela fait de l'électrocatalyse un moyen très prometteur pour produire de l'hydrogène gazeux propre.
Cependant, la réaction de dégagement d'oxygène (OER) est lente, dit Wang. Par conséquent, la vitesse de la réaction globale de fractionnement de l'eau est limitée par la lenteur de l'OER. La réaction doit être facilitée par des catalyseurs, C'est, matériaux qui favorisent la réaction sans être eux-mêmes consommés dans le processus. À ce jour, des électrocatalyseurs économiquement viables pour la promotion de la réaction de dégagement d'oxygène n'ont pas encore été développés. Wang et ses collègues se sont concentrés sur l'OER dans les électrocatalyseurs prometteurs dans le but de mieux comprendre les processus de réaction et d'utiliser ces informations pour concevoir des électrocatalyseurs plus efficaces et plus stables pour cette réaction.
Ils se sont concentrés sur la réaction d'une classe d'électrocatalyseurs à base d'oxydes de cobalt, un matériau bon marché et riche en terre, des attributs qui se traduiraient efficacement pour une utilisation à l'échelle industrielle, a dit Wang.
Au cours de la dernière décennie, divers électrocatalyseurs à base d'oxyde de cobalt sont apparus comme des candidats prometteurs pour la promotion des REL. En collaboration avec des collègues de l'Université de Yale, Wang et son équipe ont étudié l'OER sur deux types d'électrocatalyseurs à base d'oxyde de cobalt avec des techniques électrochimiques, spectroscopie infrarouge, et la théorie de la fonctionnelle de la densité.
Wang a déclaré que l'équipe contrôlait la concentration de l'eau en utilisant des électrolytes eau-dans-sel, qui présentent une concentration en sel environ dix fois supérieure à celle de l'eau de mer. Par conséquent, les chercheurs ont pu contrôler l'activité de l'eau en ajustant la quantité de sel dans l'électrolyte. Ils ont surveillé comment la vitesse de la réaction a répondu à différentes concentrations d'eau. Cela a révélé le mécanisme de l'OER sur les électrocatalyseurs à base de cobalt, a dit Wang. Le co-auteur et professeur agrégé de chimie de la Colombie-Britannique Matthias Waegele et son équipe de recherche ont utilisé la spectroscopie infrarouge, qui repose sur l'interaction de la lumière infrarouge avec des molécules, pour détecter les intermédiaires de réaction de l'OER dans les conditions opératoires.
Ils ont pu détecter un intermédiaire de réaction clé, ce qui a été prédit par les calculs du chimiste de Yale Victor Batista et de son groupe de recherche. Gary Brudvig, un chimiste inorganique à Yale, a également conseillé l'équipe pendant le projet.
Wang a déclaré que l'équipe voulait examiner de près la réaction d'évolution de l'oxygène, en particulier la caractéristique qu'il s'agit d'un processus étape par étape, pas un seul événement. L'eau ne contient qu'un seul atome d'oxygène. Le produit de l'OER est l'oxygène moléculaire, qui contient deux atomes d'oxygène. Par conséquent, pendant l'OER, une liaison oxygène-oxygène se forme, il a noté.
Wang a déclaré que les chercheurs dans ce domaine se sont concentrés sur deux questions centrales :comment cette liaison oxygène se forme-t-elle et à quelle étape ? Deux mécanismes principaux ont été proposés dans des études antérieures, cependant, les chercheurs n'avaient pas encore déterminé dans quelles conditions expérimentales :température, ou potentiel d'électrode appliqué, par exemple, la liaison oxygène-oxygène se forme et lequel des mécanismes est dominant.
Wang et ses collègues ont décidé d'examiner de près comment le potentiel d'électrode appliqué dicte le mécanisme de l'étape de formation de la liaison oxygène-oxygène, car les réactions en électrocatalyse sont entraînées par un potentiel électrique appliqué au catalyseur.
Les résultats suggèrent que le commutateur mécanique pourrait être général pour les électrocatalyseurs à base d'oxyde, a dit Wang.
"Nous sommes très intéressés à savoir si cette observation s'applique également à d'autres électrocatalyseurs prometteurs, " dit-il. " En particulier, nous travaillons actuellement sur des catalyseurs avec des centres actifs définis atomiquement. Contrairement aux électrocatalyseurs à base de cobalt, dont la structure atomique au centre actif reste irrésolue, notre nouvelle plateforme d'étude contient des centres catalytiques atomiquement bien définis. Il sera très intéressant de voir si la commutation mécanistique induite par le potentiel se produit également sur ces catalyseurs."