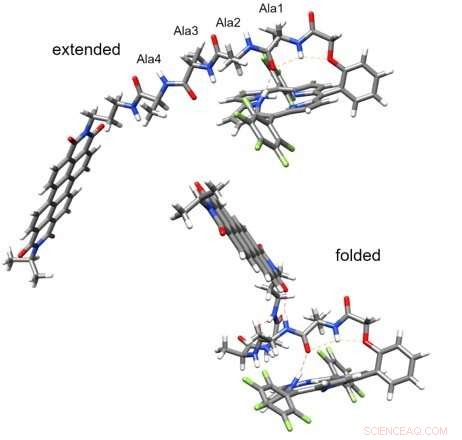
Le peptide étendu (en haut) n'intervient pas dans le transfert de charge (transfert de charge détectable). Crédit :Valentine Vullev
Flux d'énergie biologique, comme dans la photosynthèse et la respiration, dépendent du transfert d'électrons d'une molécule à une autre. Malgré son importance pour le maintien de la vie, facteurs régissant le taux de transfert d'électrons, surtout sur de longues distances, ne sont pas bien compris car les systèmes qui interviennent dans de tels processus ultrarapides sont très complexes. Une meilleure compréhension des taux de transfert d'électrons aiderait les scientifiques à améliorer les transformations chimiques, conversion de l'énergie, appareils électroniques, et les technologies photoniques.
Maintenant, une équipe internationale de chercheurs dirigée par UC Riverside a observé un transfert de charge picoseconde médié par des liaisons hydrogène dans les peptides. Une picoseconde est un trillionième de seconde. En tant qu'analogues à chaîne courte de protéines, des éléments constitutifs d'une importance cruciale des organismes vivants, les peptides sont des chaînes d'acides aminés liés chimiquement. La découverte montre le rôle des liaisons hydrogène dans le transfert d'électrons. Les résultats sont publiés dans Actes de l'Académie nationale des sciences .
Valentin Vullev, professeur de bio-ingénierie au Marlan et Rosemary Bourns College of Engineering de l'UC Riverside, avec Daniel Gryko de l'Académie polonaise des sciences, et Harry Gray du California Institute of Technology, a dirigé une équipe qui a découvert un transfert d'électrons exceptionnellement ultrarapide d'un donneur à une molécule acceptrice liée à des lieurs oligopeptidiques s'étendant jusqu'à 20 liaisons covalentes. Le transfert d'électrons prend généralement une microseconde, ou un millionième de seconde, dans des peptides avec de telles distances de liaison traversantes.
Les chercheurs ont été surpris d'observer un transfert d'électrons picoseconde, un taux 1 million de fois plus rapide que précédemment connu pour de tels systèmes.
"Ça ne devrait pas marcher, mais c'est le cas, " a déclaré Vullev. " Le transfert de charge picoseconde que nous avons observé contredit la biologie structurale, en supposant la distribution aléatoire attendue des structures des chaînes peptidiques flexibles."
L'équipe a choisi des molécules donneuses et réceptrices liées par de courts peptides qu'ils ont découverts, en fait, supposent des structures bien définies stabilisées par des liaisons hydrogène. Une analyse plus poussée a révélé que les liaisons hydrogène au sein de chaque molécule rapprochaient le donneur et l'accepteur dans une architecture moléculaire en forme de scorpion, permettant le transfert d'électrons de la picoseconde.
"Cette conception révolutionnaire démontre que les peptides courts peuvent non seulement assumer des conformations secondaires bien définies lorsqu'ils sont modelés par des composants organiques, mais également fournir un réseau de liaisons hydrogène qui peut médier le transfert d'électrons avec une efficacité inhabituellement élevée, " a déclaré Vullev. " Notre travail fournit des paradigmes sans précédent pour la conception et le développement de voies de transfert de charge le long de ponts flexibles, ainsi que des informations sur les motifs structuraux pour la médiation du transfert d'électrons dans les protéines."
Les résultats pourraient conduire à des progrès dans le stockage d'énergie ainsi qu'à stimuler le développement d'électronique organique utilisant des polymères conducteurs au lieu de minéraux conducteurs.
"L'un des aspects les plus excitants et gratifiants du travail dans notre groupe est d'être à l'avant-garde de telles découvertes et d'observer ces résultats spectaculaires, " a déclaré le co-auteur John Clark, un doctorant du laboratoire de Vullev qui a effectué des mesures photochimiques pour la recherche.
Le papier, "Rôle des liaisons hydrogène intramoléculaires dans la promotion du flux d'électrons à travers les conjugués d'acides aminés et d'oligopeptides, "