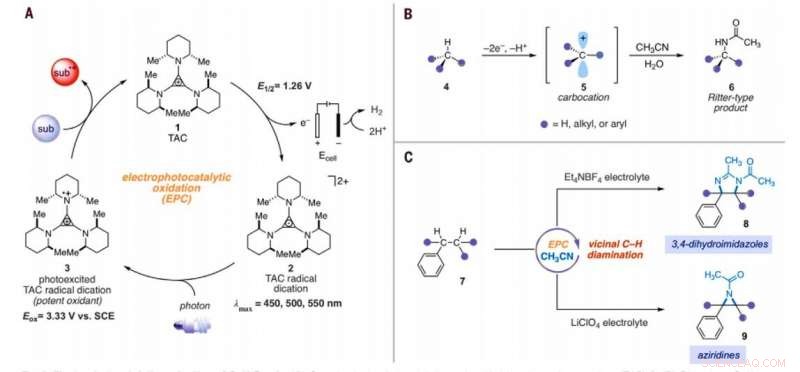
Amination électrophotocatalytique des liaisons C–H. (A) Cycle électrophotocatalytique générique avec trisaminocyclopropénium (TAC) 1. (B) Réaction d'amination C-H de type Ritter. (C) Réactions de diamination C-H vicinales électrophotocatalytiques rapportées dans ce travail. Sous, substrat; subox, substrat oxydé; Moi, méthyle; Et, éthyle; Ac, acétyle; Eox, potentiel d'oxydation; lmax, longueur d'onde d'absorption maximale. Crédit :Sciences, 10.1126/science.abf2798
Chimie inorganique, la conversion des liaisons carbone-hydrogène (C-H) inactivées en liaisons carbone-azote (C-N) est une transformation très appréciée. Les scientifiques peuvent accomplir de telles réactions sur un seul site C-H puisque la première dérivatisation peut diminuer la réactivité des liaisons C-H environnantes. Dans un nouveau rapport maintenant publié dans Science , Tao Shen et Tristan H. Lambert au département de chimie et biologie chimique, L'Université de Cornell, New York, ont montré que les arènes alkylées pouvaient subir des réactions de diamination C-H vicinales pour former 1, Dérivés de 2-diamine utilisant une stratégie électrophotocatalytique. Au cours du processus de synthèse, ils ont utilisé l'acétonitrile comme solvant et source d'azote. Ils ont catalysé la réaction en utilisant un ion trisaminocyclopropénium (TAC), qui a subi une oxydation anodique pour fournir un dication radicalaire stable (tout cation), tandis que la réaction cathodique a réduit les protons en hydrogène moléculaire. Lorsqu'ils ont irradié le dication radicalaire TAC avec une lumière fluorescente compacte à lumière blanche, ils ont généré un intermédiaire photoexcité fortement oxydant. En fonction de l'électrolyte utilisé, l'équipe a obtenu soit 3, Produits 4-dihydroimidazole ou aziridine.
Un nouveau procédé de synthèse
Les réactions chimiques omniprésentes qui convertissent les liaisons inertes carbone-hydrogène (C-H) en précieuses liaisons carbone-azote (C-N) peuvent considérablement accélérer la construction de molécules complexes pertinentes pour l'entreprise biomédicale. Les chercheurs ont donc dérivé une série de réactions d'amination C-H, mais malgré leur puissance et leur portée, de nombreuses campagnes synthétiques doivent installer de nombreux liens C-N. Un défi majeur pour le développement de telles réactions chimiques est que l'hétérofonctionnalité a tendance à désactiver les liaisons environnantes vers les modes mécanistes typiques d'activation C-H. Seules quelques technologies de réaction ont donc jusqu'à présent accompli des fonctions multipotentes sur les liaisons C-H proximales. Shen et al. a décrit une stratégie pour une chimie d'oxydation puissante en combinant l'énergie de la lumière et de l'électricité au sein d'un seul catalyseur dans un processus connu sous le nom d'électrophotocatalyse (EPC). Au cours de cette stratégie, l'équipe a utilisé l'oxydation électrochimique de l'ion trisaminocyclopropénium (TAC) sous un potentiel électrochimique relativement doux et une irradiation de lumière visible concomitante pour exciter l'intermédiaire cationique radical résultant. Le dication radicalaire photo-excité était un oxydant extrêmement puissant qui a démontré des réactions difficiles, notamment des fonctions oxydatives du benzène et d'autres arènes pauvres en électrons ou la fonctionnalisation C-H régiosélective des éthers.
Portée du substrat de la diamination C–H vicinale électrophotocatalytique. Tous les rendements sont des produits isolés. Les produits ont été obtenus sous forme de mélanges racémiques; les représentations en coin et en tirets indiquent des relations stéréochimiques relatives. (A) Diamination des alkylbenzènes secondaires. (B) Diamination des alkylbenzènes primaires. Des détails expérimentaux sont fournis dans les documents supplémentaires. Un astérisque indique un fonctionnement à 2,2 V ; un symbole en forme de dague (†) indique un traitement avec NaHCO3 (aq) et CH3OH ; et un dymbol à double dague (‡) indique nBu4NPF6 au lieu de Et4NBF4. SM, matières premières de départ. Le composé 36 a été désacylé lors du traitement. Crédit :Sciences, 10.1126/science.abf2798 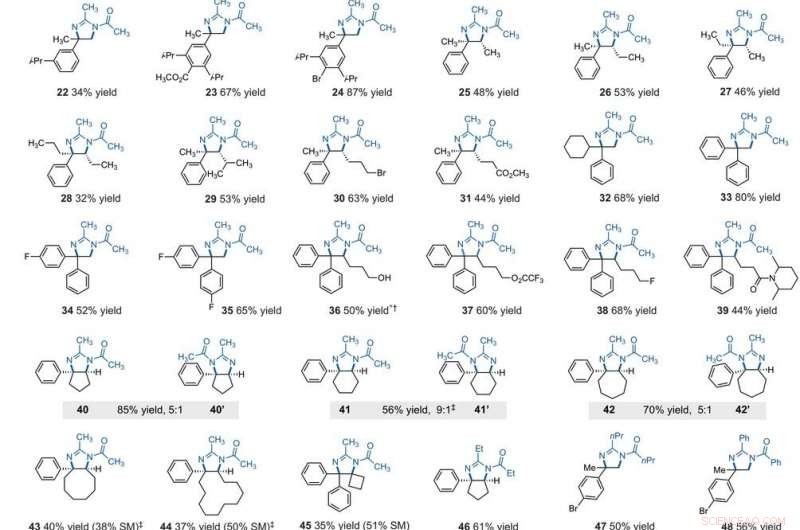
L'équipe a émis l'hypothèse que le pouvoir oxydant du TAC permettrait également d'activer d'autres collecteurs d'activation de liaison C-H. Dans les bonnes conditions, l'approche électrophotocatalytique pourrait générer des intermédiaires carbo-cationiques pour faciliter la fonctionnalisation de type Ritter des liaisons C-H sans oxydant chimique externe. Typiquement, au cours des réactions de type Ritter, génèrent un carbocation suivi d'un piégeage par un nitrile pour former des intermédiaires d'ions nitrilium suivis de produits amide après hydrolyse. L'équipe a supposé que les substances fortement oxydantes, pourtant les conditions sélectives offertes par TAC (trisaminocyclopropenium) EPC (électrophotocatalyse) pourraient permettre une séquence de multiples réactions de fonctionnalisation C-H de type Ritter, où le groupe acétamide initialement formé a facilité une seconde réaction d'amination à une position adjacente. Si possible, la méthode pourrait faciliter l'amination régiosélective de deux liaisons C-H simplement en utilisant la lumière visible, un potentiel électrochimique doux et un solvant commun comme source d'azote au lieu de précurseurs de nitrène. Shen et al. reported the realization of the electrophotocatalytic deamination of C-H bonds to furnish dihydroimidazoles or aziridines, depending on the type of electrolyte used during the experiments.
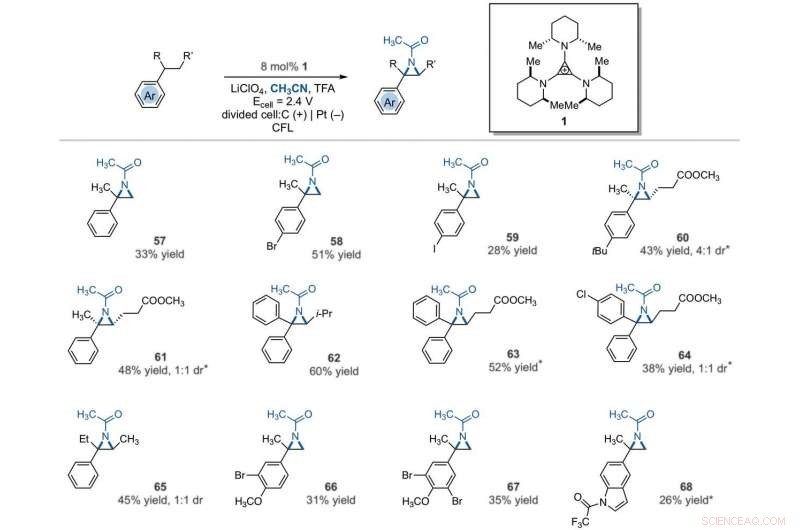
Electrophotocatalytic vicinal C–H aziridination. Detailed reaction conditions for each substrate are provided in the supplementary materials. Products were obtained as racemic mixtures; wedge and dash depictions indicate relative stereochemical relationships. An asterisk indicates run at 2.2 V. i-Pr, isopropyl. Crédit :Sciences, 10.1126/science.abf2798
The synthetic products
After extensively screening, the reaction conditions including the cell potential, électrolyte, acid additive and reaction time, Shen et al. identified conditions to assist the efficient conversion of a variety of benzylic hydrocarbons of the corresponding N-acyl-4, 5-dihydroimidazole adducts. In the reaction setup, the scientists used visible light irradiation with a white compact fluorescent light of a solution of the substrate containing TAC in a divided electrolytic cell under controlled potential. The team added the TAC catalyst and substrate within the anodic chamber where the C-H deamination chemistry occurred. The resulting redox by-product was effectively traceless. Based on similar conditions, a variety of benzylic hydrocarbons underwent vicinal C-H diamination to form diverse products. In all cases, the researchers noted how the function of methylene carbons occurred in preference to methyl carbons, even when in the presence of a sterically demanding group or electron-withdrawing group. Since the α-α-diaryl amines formed a valuable substructure in biomedically relevant compounds, the team also investigated the transformation on gem-diaryl substrates. They found that the 1, 1-diphenyl ethane reacted efficiently to furnish a secondary alkyl benzene compound with 80 percent yield. The compatibility of alcohol, ester, alkyl fluoride and amide substituents allowed the synthesis of more highly functionalized adducts.
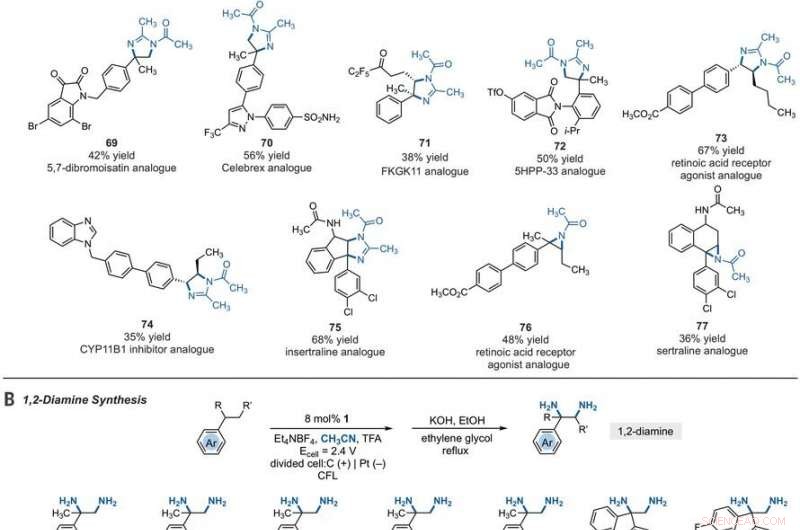
Synthetic applications of electrophotocatalytic vicinal C–H diamination. (A) Bioactive compound analogs prepared by means of electrophotocatalytic vicinal C–H diamination or aziridination. (B) 1, 2-Diamine synthesis. (C) Dihydroimidazole synthesis. (D) Bioactive compound synthesis. Detailed reaction conditions are provided in the supplementary materials. Products were obtained as racemic mixtures; wedge and dash depictions indicate relative stereochemical relationships. Products 80 and 81 were isolated as bis tosylate salts. Ph, phényle; Vf, trifluoromethanesulfonate. Crédit :Sciences, 10.1126/science.abf2798
Functionalizing ring systems
The team further studied the potential of this reaction to functionalize ring systems. The reaction of phenyl cyclopentane led to the bicyclic compound in 85 percent yield. The scientists produced six- and seven-membered ring products as regioisomeric mixtures, alongside eight- and 12-membered ring products as single isomers. They improved some of the yields for cyclic substrates by using tetrabutylammonium phosphate (TBAF
Mechanistic rationale for electrophotocatalytic vicinal C–H diamination. Voltages were measured in a 5:1 mixture of CH3CN and TFA to mimic the reaction conditions and are relative to SCE. Crédit :Sciences, 10.1126/science.abf2798 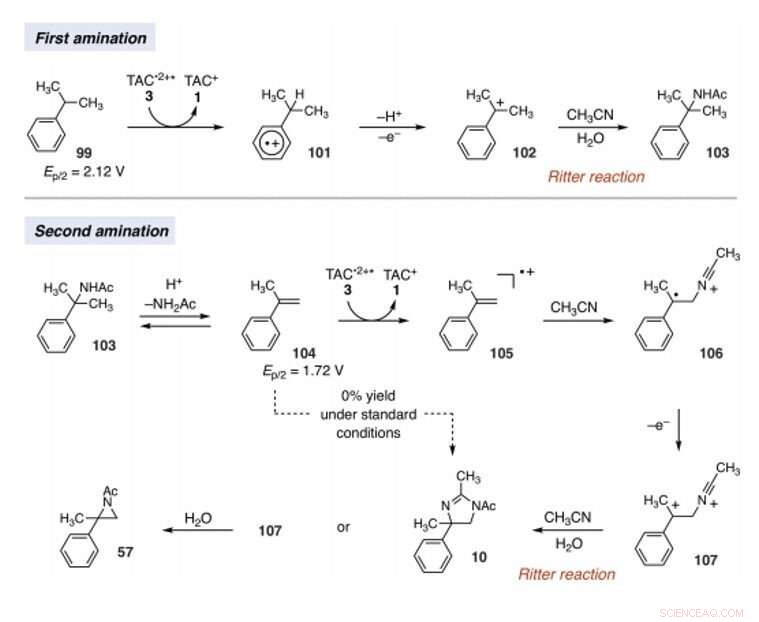
Since late-stage C-H functionalization processes offered powerful tools for the diversification of medicinal compound libraries, Shen et al. tested the difunctionalization chemistry on several molecules that are close analogs of known biologically active molecules. The team diaminated a dibromoisatin derivative to produce a bioactive molecule analogue in 42 percent yield. Par exemple, Isatin derivatives have been investigated in the past due to their medicinal properties including antitumor and antiviral activities. The scientists also found that celecoxib analogs could produce 56 percent yield under standard conditions. They then converted an analog of thalidomide with antiproliferative activity into another bioactive analog with 50 percent yield. The team further found how a small modification to the electrophotocatalytic procedure could lead to the isolation of free 1, 2-diamines in good yields. Shen et al. believe the mechanisms to have originated with Ritter-type amination of the substrates benzylic C-H bond in a process that accords with known electrochemical Ritter-type reactions. De cette façon, Tao Shen and Tristan H. Lambert noted the compatibility of deamination with a reasonable diversity of functionality for the practical applications of this reaction. The scientists used the power of combined light and electrical energy to conduct the reactions in the functionality of a single catalyst with advancing synthetic capabilities.
© 2021 Réseau Science X