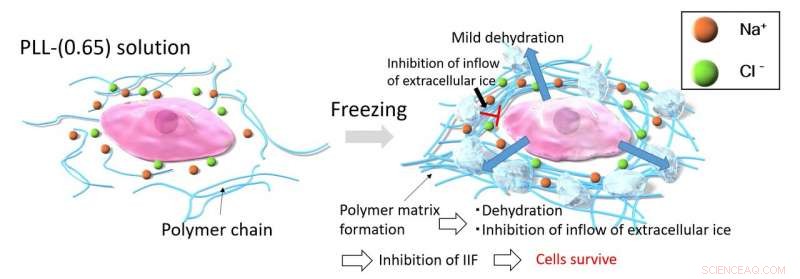
Lorsque les cellules sont congelées avec PLL-(0.65), le processus de congélation concentre les molécules PLL-(0.65), ce qui à son tour les amène à s'agréger en raison de fortes forces d'attraction intermoléculaires. Cette agrégation de PLL-(0.65) piège les ions et l'eau dans la matrice pour empêcher tout changement osmotique dramatique. La matrice polymère épaisse inhibe l'afflux de glace extracellulaire dans les cellules, ce qui évite le problème de la formation de glace intracellulaire (IIF). Photo courtoisie :Kazuaki Matsumura du JAIST.
La cryoconservation consiste à préserver le matériel biologique, comme les cellules, tissus, et organes, à des températures ultra-basse afin qu'ils puissent être relancés et utilisés à une date ultérieure. Pour réaliser une cryoconservation telle que les matériaux conservés ne soient pas endommagés, les scientifiques utilisent divers produits chimiques appelés cryoprotecteurs, qui facilitent le processus de congélation. Malheureusement, bon nombre des agents cryoprotecteurs existants ont des limitations majeures. Par exemple, le diméthylsulfoxyde est utile pour la cryoconservation des globules rouges, mais il est aussi toxique pour les cellules.
Pour surmonter ces limites, des chercheurs du Japan Advanced Institute of Science and Technology (JAIST) et du RIKEN du Japon ont expérimenté une classe de produits chimiques appelés polyampholytes, identifiant un polyampholyte nommé ε-poly-ʟ-lysine carboxylée (COOH-PLL) comme un cryoprotecteur prometteur qui n'a pas d'effets toxiques sur les cellules.
Cependant, le mécanisme par lequel COOH-PLL agit comme cryoprotecteur est resté mal compris, et cela a entravé les efforts pour développer de meilleurs cryoprotecteurs polyampholytes. Pour combler ce manque de connaissances, cette équipe de chercheurs, qui était dirigé par le professeur Kazuaki Matsumura de JAIST—et qui comprenait également l'Asst. Le professeur Robin Rajan de JAIST et le Dr Fumiaki Hayashi et le Dr Toshio Nagashima de RIKEN ont mené une autre étude dans laquelle ils ont utilisé une méthode appelée spectroscopie de résonance magnétique nucléaire (RMN) à l'état solide pour caractériser ce qui arrive aux molécules d'eau, les ions sodium et chlorure, et une forme de COOH-PLL appelée PLL-(0,65) lorsqu'elles sont mélangées et congelées aux températures utilisées en cryoconservation. Leurs résultats apparaissent dans un numéro récent de la revue à comité de lecture Communications Materials.
Comme prévu, les signaux RMN enregistrés à partir de ces solutions congelées indiquaient une mobilité réduite au niveau moléculaire et une viscosité accrue de la solution (c'est-à-dire, résistance accrue à l'écoulement) à des températures ultra-basses. Surtout, les molécules PLL-(0,65) ont piégé les molécules d'eau et les ions d'une manière qui a empêché la formation de cristaux de glace intracellulaires et a contré les effets du choc osmotique (une forme de dysfonctionnement physiologique dans lequel un changement soudain des concentrations d'ions autour d'une cellule peut conduire à entrée ou sortie rapide de fluide dans ou depuis la cellule, l'endommager). Les cristaux de glace intracellulaires et le choc osmotique sont des causes majeures de dommages cellulaires ou tissulaires lors de la congélation, ainsi, la capacité de la PLL-(0,65) à empêcher les deux contribue à expliquer son efficacité en tant que cryoprotecteur.
En décrivant la valeur scientifique de ces découvertes, Le professeur Matsumura note que l'utilisation de la RMN « a permis de caractériser les propriétés cryoprotectrices des polymères qui fonctionnent par des mécanismes différents de ceux des cryoprotecteurs actuels ». Il prédit que cette caractérisation « facilitera la conception moléculaire de nouveaux cryoprotecteurs, " qui " favorisera l'utilisation clinique d'agents cryoprotecteurs polymères qui peuvent servir d'alternatives efficaces aux agents à petites molécules tels que le diméthylsulfoxyde et le glycérol ".
Les cryoprotecteurs à petites molécules ne sont utiles que pour préserver les cellules et les petits tissus, mais les cryoprotecteurs polymères peuvent permettre aux chercheurs d'obtenir la cryoconservation de volumes de tissus plus importants ou même d'organes entiers. Ce serait une avancée importante pour des domaines émergents tels que la médecine régénérative, qui vise à restaurer des fonctions physiologiques normales en remplaçant ou en régénérant des cellules, tissus, et organes.
Les découvertes de l'équipe peuvent également avoir des implications importantes pour la biologie fondamentale. Dans les années récentes, les scientifiques ont appris que les protéines intrinsèquement désordonnées, qui n'ont pas de forme tridimensionnelle fixe, jouent un rôle important dans la protection des cellules contre les dommages liés à la dessiccation et au choc osmotique à basse température. Parce que les protéines sont elles-mêmes une classe de polyampholytes, ces découvertes récemment publiées concernant le comportement de COOH-PLL à des températures ultra-basses peuvent aider à expliquer les mécanismes par lesquels les protéines intrinsèquement désordonnées protègent les cellules. Des recherches plus poussées sur les mécanismes de ces protéines peuvent à leur tour conduire au développement de matériaux avancés avec des utilisations en médecine régénérative.
En conclusion, ces découvertes peuvent être d'une valeur considérable pour la biologie et la médecine. « Sur la base de notre compréhension désormais améliorée des mécanismes des agents cryoprotecteurs polymères, " note le Pr Matsumura, « nous prévoyons de développer de nouvelles technologies de cryoconservation pour de grands volumes de tissus et d'organes, qui permettra la mise en œuvre à l'échelle industrielle de la médecine régénérative via la mise en place de banques de tissus artificiels.