
Cristaux d'AR3 observés en lumière polarisée (à gauche). Crédit : le droit d'auteur des images appartient aux auteurs selon les termes et conditions de Nature Communications
Pour la première fois, une équipe internationale de chercheurs a visualisé la protéine photosensible archaerhodopsin-3 (AR3) à une résolution sans précédent en utilisant les lignes de lumière I24 et B23 à Diamond Light Source. Le photorécepteur est exprimé par Halorubrum sodomense, un organisme qui pousse dans la mer Morte, mais est surtout connu pour ses applications dans les expériences d'optogénétique, dans lequel il est utilisé pour faire taire les neurones individuels et pour détecter les changements de tension de la membrane cellulaire. Ces nouvelles structures ouvrent la voie au développement de nouveaux outils et méthodologies dans les domaines des neurosciences, biologie cellulaire et au-delà.
Dans leur papier, publié aujourd'hui dans Communication Nature , l'équipe rapporte la toute première structure de l'état fondamental d'AR3. Dans cet état, la protéine est configurée pour transporter un H + ion à travers la membrane cellulaire pour chaque photon absorbé. L'équipe a également pu cristalliser le photorécepteur dans une seconde conformation, un état désensibilisé qui est adopté par AR3 en l'absence prolongée de lumière.
Selon l'auteur correspondant, le professeur Anthony Watts de l'Université d'Oxford; "La superbe résolution que nous avons obtenue pour ces structures AR3, 1,07 Å pour l'état fondamental, est parmi les plus élevées pour une protéine membranaire de type sauvage déposée à ce jour dans la Protein Data Bank. Cette qualité nous permet de visualiser directement la distribution complexe des molécules d'eau à l'intérieur du récepteur et de décrire la signification fonctionnelle des réseaux complexes de liaisons hydrogène qu'elles forment, quelque chose d'important dans de nombreuses biomolécules, pas seulement les photorécepteurs. Ces réseaux dans AR3 impliquent des interactions avec le groupe rétinien et les chaînes latérales d'acides aminés et, Dans cet article, nous avons montré comment ils sont modifiés entre l'état fondamental et l'état désensibilisé de la protéine."
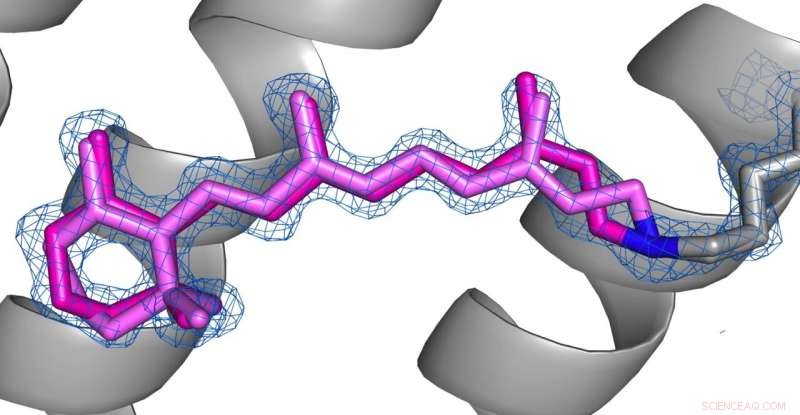
Comparaison des conformations de la rétine (rose) à l'état désensibilisé (photo 1) et à l'état fondamental (photo 2) de l'AR3. Crédit : le droit d'auteur des images appartient aux auteurs selon les termes et conditions de Nature Communications
Expliquer la signification de la protéine AR3, commentaires du co-premier auteur, le Dr Juan Francisco Bada Juarez; "Les développements passionnants de l'optogénétique au cours de la dernière décennie ont suscité un vif intérêt pour l'AR3 de la part des scientifiques du monde entier. Des mutants de la protéine sont couramment utilisés dans des expériences en neurosciences pour faire taire de manière sélective les cellules nerveuses individuelles et également pour détecter les changements de tension transmembranaire. Cependant , ces mutants ont été conçus sans connaître la structure de la protéine elle-même. Nos données fournissent aux biologistes structurels et aux ingénieurs en protéines les « plans » d'AR3 et, par conséquent, nous pouvons nous attendre à une accélération significative du développement de nouveaux outils optogénétiques. »
L'auteur co-correspondant, le Dr Isabel Moraes du National Physical Laboratory (NPL) ajoute :
"Les données de diffraction à très haute résolution nous ont permis d'observer en détail la liberté de mouvement de plusieurs acides aminés clés et molécules d'eau individuelles à l'intérieur du photorécepteur. La résolution des structures AR3 était extrêmement difficile, en raison de la complexité des caractéristiques que nous pouvons distinguer à la résolution atomique. De nombreuses chaînes latérales d'acides aminés à l'intérieur de la protéine ont été résolues dans plus d'une position ou orientation, indiquant leur importance pour la fonction des protéines. La connaissance de la dynamique de ces groupes était essentielle pour comprendre comment se déroulent les processus de sensibilisation et de désensibilisation."
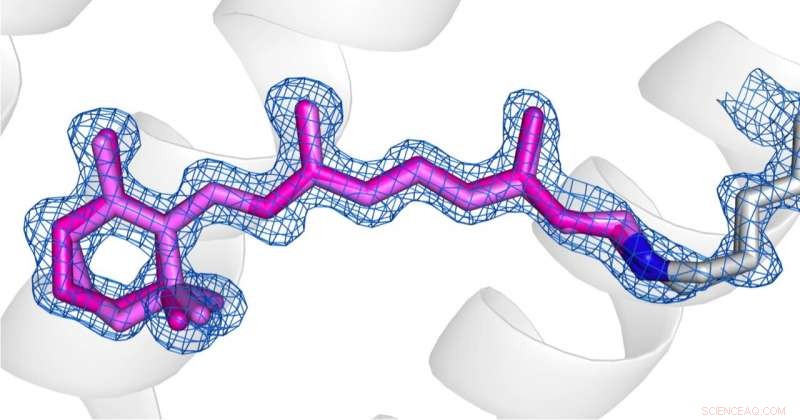
Comparaison des conformations de la rétine (rose) à l'état désensibilisé (photo 1) et à l'état fondamental (photo 2) de l'AR3. Crédit : le droit d'auteur des images appartient aux auteurs selon les termes et conditions de Nature Communications
Indispensable pour comprendre le fonctionnement de la protéine, étaient les structures cristallines à haute résolution résolues par l'équipe. L'obtention de données de diffraction d'une telle qualité n'aurait pas été possible sans la ligne de lumière microfocus à la pointe de la technologie à la source lumineuse Diamond, le synchrotron national du Royaume-Uni, près de Didcot dans l'Oxfordshire. L'équipe a travaillé en étroite collaboration avec plusieurs experts de Diamond.
« Les microcristaux cultivés par les équipes d'Oxford et du NPL étaient parfaitement adaptés aux capacités de la ligne de lumière I24. À l'aide d'un logiciel développé par le groupe de développement logiciel DIALS de Diamond, nous avons pu combiner des images de diffraction de plusieurs cristaux pour obtenir des ensembles de données complets. La combinaison d'une livraison précise de rayons X par microfocus et d'une analyse avancée des données nous a permis de repousser les limites de la résolution des structures résultantes. » déclare le Dr Danny Axford, scientifique senior en ligne de faisceau de Diamond.
En conclusion, le professeur Watts ajoute :"Ce fut une étude fascinante. Ce fut un plaisir de travailler avec autant de collègues experts au Royaume-Uni et dans le monde. Non seulement nous avons maintenant une connaissance très détaillée des structures de deux états fonctionnels importants de AR3, mais les connaissances acquises approfondissent notre compréhension de la façon dont les processus de sensibilisation et de désensibilisation se produisent dans de nombreuses autres protéines réceptrices. »