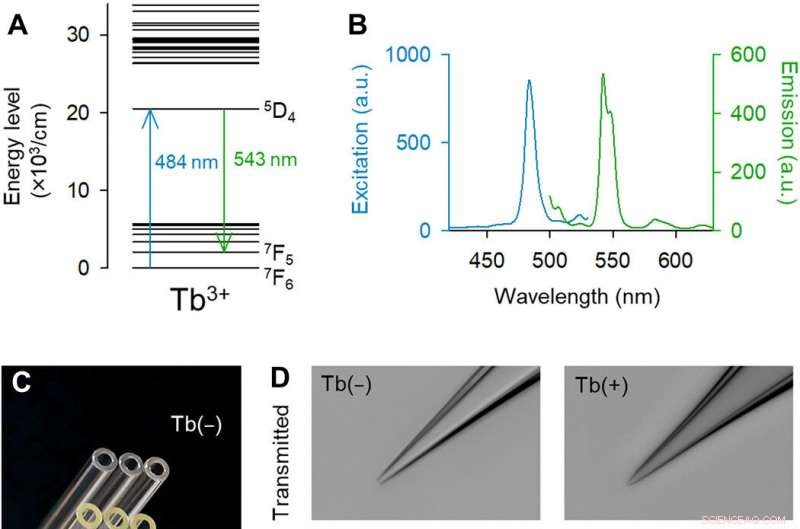
Les pipettes dopées Tb3+ émettent une fluorescence verte. (A) Diagramme de niveau d'énergie partiel de Tb3+ [extrait partiellement de (14)]. (B) Spectres d'excitation (bleu) et d'émission (vert) de 3,1 % en moles de verre dopé au Tb3+. (C) Photographie couleur macroscopique des capillaires de contrôle (en haut) et en verre dopé au Tb3+ (en bas). Crédit photo :Yuji Ikegaya, L'Université de Tokyo. (D) Images monochromatiques à fond clair (en haut) et en fluorescence (en bas) des pointes de contrôle (à gauche) et de pipettes en verre dopées au Tb3 + (à droite) (excitation laser de 488 nm à 25 mW). Les pipettes en verre dopé Tb3+ émettent une fluorescence verte. Crédit photo :Kazuki Okamoto, L'Université de Tokyo et l'Université Juntendo. (E) Image en microscopie électronique à balayage de la pointe d'une pipette dopée au Tb3+. Crédit photo :Hiroyuki Hioki, Université Juntendo. (F) Résistances de pipette de contrôle (noir) et pipettes dopées Tb3+ (vert). Les rectangles montrent les médianes et les 25e et 75e centiles, et les moustaches affichent les 10e et 90e centiles. n =48 pipettes, Test t de Student. (G) Identique à (F) mais pour les capacités des pipettes. n =7 à 8 pipettes, Test t de Student. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abd2529
Les investigations optiques et les manipulations forment souvent le cœur des expériences biologiques. Dans un nouveau rapport maintenant publié dans Avancées scientifiques , Kazuki Okamato et une équipe de scientifiques en sciences pharmaceutiques, neurosciences, Médicament, physique et intelligence artificielle à l'Université de Tokyo, Japon, a introduit un nouveau matériau en verre borosilicaté contenant un ion de terre rare terbium (III) (Tb 3+ ). Le matériau a émis une fluorescence verte lors de l'excitation de la lumière bleue, un peu comme la protéine fluorescente verte (GFP) avec une large compatibilité dans les environnements de recherche biologique. A l'aide de micropipettes en verre dopé au terbium, Okamato et al. des cellules marquées GFP ciblées pour l'électroporation monocellulaire, analyse du transcriptome unicellulaire et expériences d'enregistrement patch-clamp sous contrôle microscopique de fluorescence en temps réel. Le verre a également montré une génération potentielle de troisième harmonique lors d'une excitation laser infrarouge, utile pour le ciblage optique en ligne des neurones marqués par fluorescence dans le néocortex in vivo. De cette façon, le verre dopé au terbium a simplifié de multiples procédures dans les expériences biologiques avec des applications plus larges dans la recherche biomédicale.
Mener des investigations optiques in vivo
Les investigations optiques et les manipulations cellulaires dans les tissus vivants sont répandues dans la recherche biologique avec la capacité de révéler diverses propriétés dans les cellules et au cours de la communication intracellulaire. Alors que le marquage génétique a permis l'identification de cellules exprimant des protéines fluorescentes, il reste difficile d'accéder aux cellules marquées par fluorescence à l'aide de pipettes en verre car le verre n'est pas fluorescent dans le domaine visible. Pour résoudre ces problèmes techniques, Okamato et al. introduit une nouvelle composition de verre borosilicaté. Les ions de terres rares présentaient une émission de fluorescence unique avec des pics nets dans le spectre de la lumière visible. L'équipe s'est concentrée sur le terbium (III) (Tb 3+ ), qui ont des structures de niveau d'énergie complexes et devraient théoriquement émettre une fluorescence verte. La longueur d'onde d'excitation était proche de la visibilité la plus élevée pour les yeux humains et proche de celle de la protéine fluorescente verte. Par conséquent, les pipettes en verres dopés au terbium étaient utiles pour la fluorescence ciblée, manipulation unicellulaire en sciences de la vie.
Electroporation monocellulaire ciblée par fluorescence et analyse du transcriptome à l'aide de pipettes dopées Tb3+. (A) Électroporation de gènes monocellulaires à l'aide de pipettes dopées au Tb3+. Une pipette dopée Tb3+ contenant un vecteur pCMV-tdTomato a été attachée à une cellule pyramidale hippocampique positive EGFP dans une culture organotypique (en haut; DiV 16), et des impulsions électriques ont été appliquées. Après 48 heures, le neurone ciblé a exprimé tdTomato (en bas). Barre d'échelle, 20 µm. (B) Patch-seq en utilisant des pipettes dopées Tb3+. Une pipette dopée Tb3+ a été attachée à un interneurone GABAergique GFP-positif dans une tranche corticale aiguë d'une souris transgénique PV-GFP, et l'ARN a été extrait en appliquant une aspiration (en haut). Barre d'échelle, 50 µm. Transcriptions par million (TPM) de cellules GFP-positives et GFP-négatives (en bas). Les points gris indiquent tous les transcrits génétiques détectés. Les points rouges sont des transcrits de gènes uniques représentatifs, Pvalb et Gad2 (GAD65) pour les cellules GFP-positives contre Mef2c et Slc17a7 (VGLUT1) pour les cellules non GFP-positives. Crédit photo :Kazuki Okamoto, L'Université de Tokyo et l'Université Juntendo. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abd2529 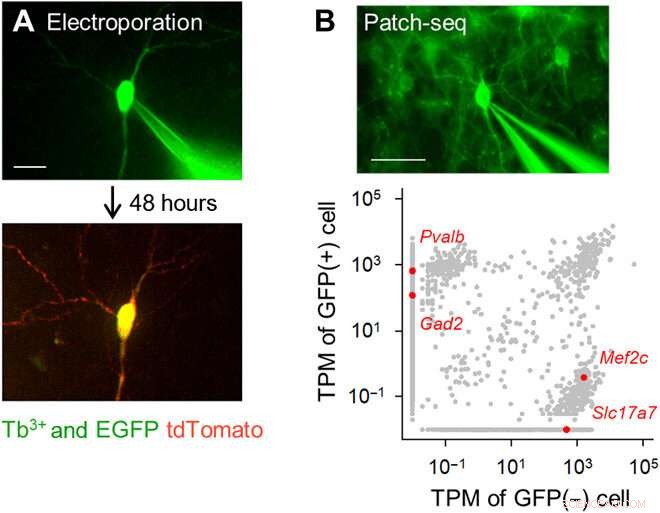
L'équipe a développé le verre borosilicaté en utilisant 3,1 pour cent en moles (% en moles) d'oxyde de terbium (Tb
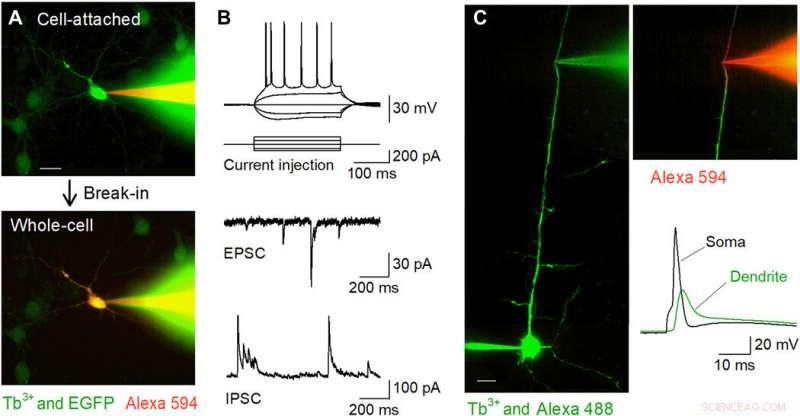
Enregistrements de patch-clamp ciblés par fluorescence in vitro à l'aide de pipettes dopées au Tb3+. (A) Images confocales Nipkow-disk lors de l'enregistrement de patch-clamp à partir d'un neurone hippocampique cultivé positif à l'EGFP (vert) à l'aide d'une pipette dopée Tb3 + (vert) remplie d'Alexa Fluor 594 (rouge). La cellule a été piégée en mode cellule attachée (en haut) puis maintenue en mode cellule entière (en bas). Barre d'échelle, 20 µm. (B) Formes d'onde représentatives des potentiels d'action induits par l'injection de courant (en haut), EPSC spontanés (milieu), et IPSCs spontanés (en bas) enregistrés à partir de cellules pyramidales CA1 dans des tranches aiguës d'hippocampe à l'aide de pipettes dopées au Tb3+. (C) Enregistrements de patch-clamp dendritiques ciblés à l'aide de pipettes dopées au Tb3+. Une cellule pyramidale de couche 5 a été chargée de manière intracellulaire avec Alexa Fluor 488 via un enregistrement somatique de cellules entières, et sa dendrite apicale a été ciblée pour un enregistrement ultérieur de cellules entières à l'aide d'une pipette dopée au Tb3 + sous visualisation confocale Nipkow-disk. Barre d'échelle, 20 µm. Après l'effraction, la dendrite a été visualisée par Alexa Fluor 594 chargée en intracellulaire via la pipette dopée Tb3+ (en haut à droite). Un potentiel d'action rétropropageant a été enregistré par la pipette dopée Tb3+ suite à un potentiel d'action évoqué dans le soma (en bas à droite). Crédit photo :Kazuki Okamoto, L'Université de Tokyo et l'Université Juntendo. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abd2529
Utilisation des nouvelles micropipettes pour les enregistrements de patch-clamp in vitro
Les chercheurs ont ensuite effectué des enregistrements patch-clamp à partir de cultures primaires de neurones hippocampiques faiblement marqués avec de la GFP à l'aide d'une pipette dopée au terbium chargée d'un colorant fluorescent rouge (Alexa Fluor 594). Les pipettes ont rempli avec succès les cellules cibles avec le colorant et les ont maintenues dans la configuration de la cellule entière. L'équipe a appliqué la même méthode à des préparations de tranches de cerveau aiguës où les neurones étaient situés plus profondément dans des tissus moins transparents que les neurones en culture. Quand Okamato et al. cellules pyramidales patchées dans les tranches aiguës d'hippocampe à l'aide de pipettes dopées au terbium, les neurones ont montré des potentiels d'action normaux en réponse à de brèves injections de courant. Les cellules présentaient des courants post-synaptiques spontanés excitateurs et inhibiteurs normaux sous la configuration voltage-clamp. Les micropipettes pouvaient être utilisées pour des enregistrements stables à long terme et étaient également utiles pour les enregistrements à partir de neurites. L'équipe a enregistré des potentiels d'action de rétropropagation en utilisant la configuration des dendrites ciblées.
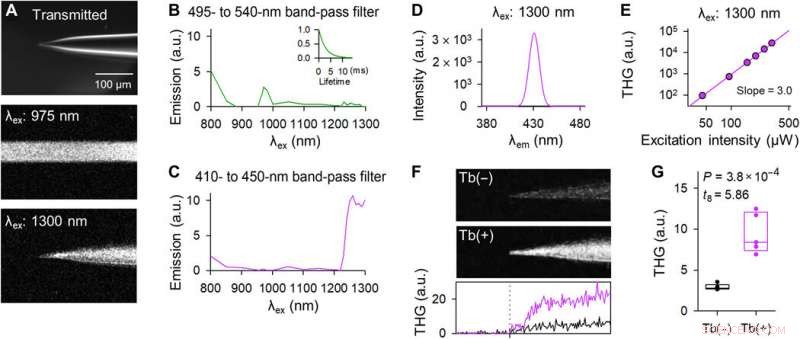
Les pipettes dopées au Tb3+ émettent du THG lors d'une excitation laser à 1300 nm. (A) Images représentatives de la pointe d'une pipette dopée au Tb3+ dans le fond clair (en haut), fluorescence à deux photons sur excitation laser à 975 nm (milieu), et émission harmonique à trois photons lors d'une excitation laser à 1300 nm (en bas). Les images du milieu et du bas ont été acquises avec un balayage horizontal de 2 µs par pixel et z-empilées. (B) Le spectre d'excitation à travers un filtre passe-bande de 495 à 540 nm. Le graphique en médaillon indique la courbe de décroissance de la fluorescence lors d'une excitation à 975 nm. (C) Identique à (B) mais à travers un filtre passe-bande de 410 à 450 nm. (D) Le spectre d'émission après excitation à 1300 nm a été mesuré à l'aide d'un monochromateur. (E) Double tracé logarithmique de l'intensité THG en fonction de la puissance laser de 1300 nm. La droite de régression avait une pente de 3,0. (F) Images THG des pointes des pipettes de contrôle (en haut) et dopées au Tb3+ (au milieu). Les images ont été empilées en Z. Le graphique du bas représente l'intensité THG du contrôle (noir) et des pipettes dopées Tb3+ (violet). La ligne pointillée verticale indique l'emplacement de la pointe. (G) Les intensités THG des pipettes dopées au Tb3+ (violet) étaient plus fortes que celles des pipettes témoins (noir). Les rectangles montrent les médianes et les 25e et 75e centiles. n =5 pipettes, Test t de Student. Crédit photo :Teppei Ebina, L'Université de Tokyo. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abd2529
Enregistrements patch-clamp in vivo à l'aide de pipettes dopées au terbium
Okamato et al. next characterized the nonlinear multiphoton excitation of terbium-doped glass using infrared light at wavelengths that were approximately double the single-photon excitation peak (484 nm) of terbium. Using a photomultiplier tube through a 495-to-540 nm band-pass filter, the team captured the green fluorescence emitted by terbium-doped pipettes. The emissions peaked at an excitation wavelength of 975 nm, suggesting that a laser wavelength corresponding to the value excited the glass through a two-photon absorption process. The scientists also noted another bright signal at 1300 nm excitation through a 410-to-450 band pass filter and suggested the signal to have likely arisen from third harmonic generation (THG). Based on the strong THG signal of the micropipettes, Okamato et al. conducted in vivo whole cell patch-clamp recordings with a multiphoton laser microscope. They simultaneously used the cells and terbium-doped pipette using dual-laser irradiation at 1, 040 nm and 1, 300 nm, respectivement, and recorded the injection-induced action potentials and spontaneous membrane fluctuations under the current-clamp configuration.
THG-based in vivo patch-clamp recordings using Tb3+-doped pipettes. (A) Multiphoton image of an in vivo patch-clamp recording guided by THG of Tb3+-doped pipettes, targeting a cell labeled with tdTomato, which underwent two-photon excitation by a 1040-nm laser (red). The THG of the Tb3+-doped pipette was obtained using a 1300-nm laser (green). (B) Action potentials evoked by a step current injection (bottom) into a layer 2/3 pyramidal cell in the primary motor cortex (top) of an anesthetized mouse were recorded using a Tb3+-doped pipette. (C) Spontaneous membrane potentials were recorded using a Tb3+-doped pipette. Photo credit:Teppei Ebina, L'Université de Tokyo. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abd2529 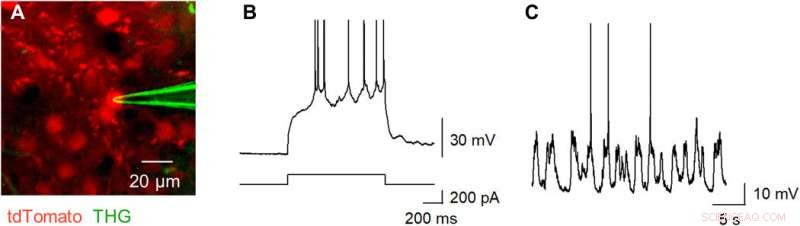
De cette façon, Kazuki Okamato and colleagues invented a terbium-doped glass emitting green fluorescence signal strong enough to be visible to the naked eye. The material had similar characteristics to conventional borosilicate glass and did not display photobleaching or cytotoxicity. The new micropipettes allowed fluorescence manipulations such as optical targeting of single-cell electroporation, single-cell RNA sequencing and electrophysiological recordings. The glass also emitted third harmonic generation upon three-photon excitation, applicable for in vivo manipulation. The terbium-doped glass therefore provided a platform for multiple purposes in biomedical research including hitherto conventional patch-clamp recordings to open new frontiers in life sciences.
© 2021 Science X Network