2 la remédiation doit être explorée.
Le piégeage géologique peut jouer ici un rôle majeur. Les roches et les sédiments souterrains de notre planète offrent un vaste espace potentiel pour le stockage à long terme du carbone. Pour soutenir cela, une étude informatique récente d'un groupe international dirigé par des Japonais à l'Université de Kyushu montre comment le dioxyde de carbone piégé peut être converti en minéraux inoffensifs.
Les roches sous la surface de la terre sont très poreuses, et le piégeage consiste à injecter du CO 2 dans les pores après l'avoir collecté à partir de sa source d'émission. Bien que le CO 2 est généralement considéré comme trop stable pour réagir chimiquement avec la roche, il peut se lier étroitement à la surface par adsorption physique. Finalement, il se dissout dans l'eau, formation d'acide carbonique, qui peuvent réagir avec les métaux aqueux pour former des minéraux carbonatés.
"La minéralisation est la méthode la plus stable de CO à long terme 2 espace de rangement, verrouillage du CO 2 sous une forme totalement sécurisée et non réémise, " explique Jihui Jia de l'Institut international de recherche sur l'énergie neutre en carbone (I
2
CNER), Université de Kyushu, premier auteur de l'étude. "On pensait autrefois que cela prenait des milliers d'années, mais ce point de vue change rapidement. Les réactions chimiques ne sont pas entièrement comprises car elles sont si difficiles à reproduire en laboratoire. C'est là qu'intervient le mannequinat."
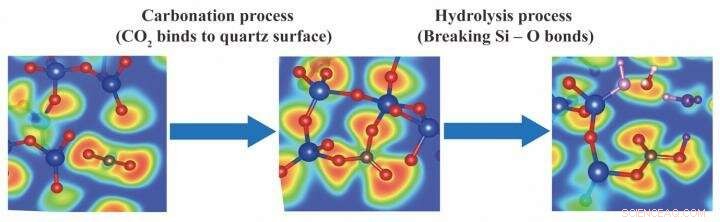
Comme indiqué dans Le Journal de Chimie Physique C , des simulations ont été initialement exécutées pour prédire ce qui se passe lorsque le dioxyde de carbone entre en collision avec une surface de quartz clivé—quartz (SiO 2 ) étant abondant dans la croûte terrestre. Lorsque les trajectoires de simulation ont été rejouées, le CO 2 les molécules ont été vues se plier de leur forme linéaire O=C=O pour former du CO trigonal 3 unités liées au quartz.
Dans une deuxième série de simulations, H 2 Des molécules d'O ont été ajoutées pour imiter « l'eau de formation » qui est souvent présente sous les sites de forage pétrolier et gazier. Curieusement, le H 2 Les molécules O attaquent spontanément le CO réactif 3 structure, rompre les liaisons Si-O pour produire des ions carbonate. Tout comme l'acide carbonique, les ions carbonate peuvent réagir avec les cations métalliques dissous (tels que Mg 2
+
, Californie 2
+
, et Fe 2
+
) pour lier le carbone de façon permanente sous forme minérale.
Ensemble, les simulations montrent que les deux étapes de CO 2 la minéralisation—la carbonatation (fixation à la roche) et l'hydrolyse (réaction avec l'eau)—sont favorables. De plus, les ions carbonates libres peuvent être produits par hydrolyse, pas seulement par dissociation de l'acide carbonique comme on le supposait autrefois. Ces connaissances reposaient sur une forme sophistiquée de dynamique moléculaire qui modélise non seulement les collisions physiques entre les atomes, mais transfert d'électrons, l'essence de la chimie.
"Nos résultats suggèrent des pistes pour améliorer le piégeage géologique, " dit l'auteur principal de l'étude Takeshi Tsuji. "Pour que le quartz capture le CO 2 , ce doit être une surface clivée, les atomes de silicium et d'oxygène ont donc des liaisons réactives « pendantes ». Dans la vraie vie, cependant, la surface peut être protégée par des liaisons hydrogène et des cations, ce qui empêcherait la minéralisation. Nous avons besoin d'un moyen de retirer ces cations ou de déshydrogéner la surface."
De plus en plus de preuves montrent que le CO capturé 2 peut se minéraliser beaucoup plus rapidement qu'on ne le croyait auparavant. Bien que ce soit excitant, l'article de Kyushu souligne à quel point la chimie peut être complexe et délicate. Pour l'instant, le groupe recommande des études complémentaires sur d'autres roches abondantes, comme le basalte, pour cartographier le rôle que le piégeage géochimique peut jouer dans le plus grand défi technique auquel est confrontée la civilisation.