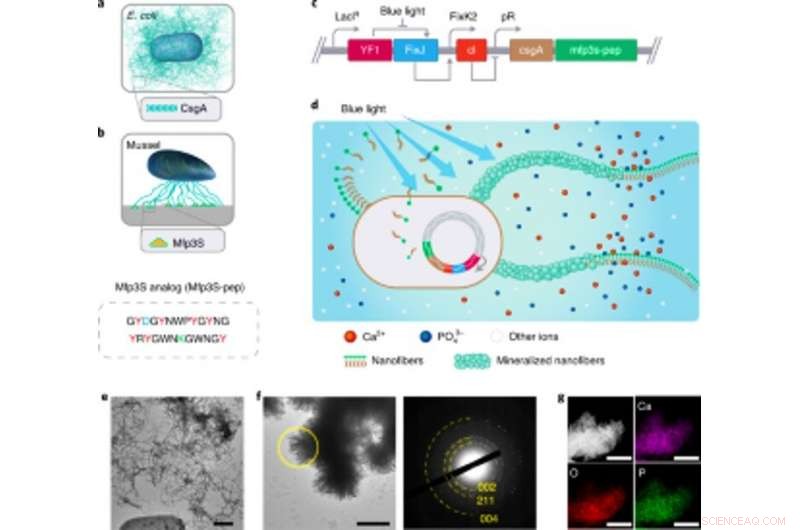
Conception de biofilms fonctionnels E. coli sensibles à la lumière comme échafaudages pour la minéralisation de HA. Conception de biofilms fonctionnels E. coli sensibles à la lumière comme échafaudages pour la minéralisation de HA. (a) Illustration schématique de biofilms d'E. coli de type sauvage comprenant des nanofibres amyloïdes CsgA extracellulaires, qui sont des composants majeurs des protéines du biofilm qui contribuent à une adhérence robuste des biofilms aux surfaces solides. (b) Illustration schématique des Mfps des plaques adhésives de la moule de Californie M. californianus. Mfp3S-pep (ci-dessous) est un peptide adhésif bio-inspiré qui imite la protéine Mfp3S originale trouvée dans les plaques adhésives de M. californianus. Mfp3S-pep est enrichi en acide aspartique (bleu), résidus de lysine (vert) et de tyrosine (rouge), connus pour leurs rôles fonctionnels dans la promotion de la nucléation, croissance et adhésion de HA. (c) Schéma montrant les composants génétiques du biofilm d'E. coli sensible à la lumière. La conception de biofilms fonctionnels a été permise en fusionnant des séquences codant pour la protéine CsgA et Mfp3S-pep, tous deux positionnés en aval de l'élément de contrôle transcriptionnel pDawn sensible à la lumière. Dans le circuit pDawn, l'expression constitutive de l'histidine kinase YF1 et de son régulateur de réponse apparenté FixJ est étroitement régulée par le promoteur LacIq, tandis que l'expression du répresseur du phage λ cl est contrôlée par le promoteur FixK2. Lors d'un éclairage à la lumière bleue, l'activité kinase de YF1 et l'expression conséquente de cI sont toutes deux inhibées, qui à son tour active le promoteur λ pR pour promouvoir l'expression de CsgA-Mfp3S-pep. (d) Schéma montrant le dépôt local de minéraux HA sur les nanofibres extracellulaires fonctionnelles composées de protéines de fusion CsgA-Mfp3S-pep, sécrété par E. coli modifié sensible à la lumière, la souche lightreceiver-CsgA–Mfp3S-pep. (e) Image TEM montrant les cellules et la matrice extracellulaire avec des fibres amyloïdes abondantes dans les biofilms. Barre d'échelle, 500 nm. F, Image MET montrant le composite formé et les cristaux en forme de latte précipités à la surface des nanofibres extracellulaires après 7 d de minéralisation dans 1,5× SBF. Le motif SAED correspondant présente des arcs de diffraction attribués au (002), (211) et (004) avions. Barre d'échelle, 500 nm. g, Cartographie EDS illustrant le Ca, Éléments O et P intrinsèquement affectés à la phase HA. Barres d'échelle, 500 nm. Crédit: Nature Chimie Biologie , doi :https://doi.org/10.1038/s41589-020-00697-z
Les organismes vivants ont développé des mécanismes de biominéralisation pour construire des matériaux composites structurellement ordonnés et adaptés à l'environnement. Alors que les équipes de recherche ont considérablement amélioré la recherche sur la minéralisation biomimétique en laboratoire, il est encore difficile de concevoir des composites minéralisés avec des caractéristiques structurelles et des composants vivants très similaires à leurs homologues natifs. Dans un nouveau rapport maintenant publié le Nature Chimie Biologie , Yanyi Wang et une équipe de recherche en physique, matériaux avancés, la biologie de synthèse, et l'ingénierie en Chine, a développé des composites vivants à motifs et dégradés inspirés de matériaux naturels. Ils ont couplé la formation de biofilm bactérien inductible par la lumière avec la minéralisation biomimétique d'hydroxyapatite (HA) dans ce travail, pour montrer comment l'emplacement et le degré de minéralisation pourraient être contrôlés. Les cellules des composites sont restées viables tout en détectant et en répondant aux signaux environnementaux. Les composites ont montré une augmentation de 15 fois du module de Young (c'est-à-dire, raideur, le rapport entre la contrainte et la déformation) après minéralisation. Le travail éclaire pour développer des composites vivants avec une réactivité dynamique et une adaptabilité environnementale.
Biominéralisation en laboratoire
L'organisme vivant peut produire une variété de structures composites organiques-inorganiques hiérarchiques basées sur la biominéralisation, où des exemples notables incluent les dents radulaires des chitons, des écailles de poisson et des mandibules d'écrevisses qui remplissent diverses fonctions biologiques. Le moment et le degré de biominéralisation doivent être contrôlés avec précision par les cellules pour former des structures et des fonctions précises dans les organismes vivants. Des recherches récentes sur la minéralisation biomimétique ont souligné l'importance d'explorer des approches contrôlées par les cellules pour produire des modèles vivants et des composites gradués en tant que domaine prometteur mais largement inexploré. Les disciplines de la biologie synthétique et de la science des matériaux ont déclenché une gamme de circuits génétiques sophistiqués et respectueux de l'environnement pour bio-concevoir une gamme de nouvelles fonctions cellulaires. Dans ce travail, Wang et al. développé bio-inspiré, matériaux composites vivants en exploitant des biofilms d'Escherichia coli inductibles par la lumière couplés à une minéralisation biomimétique. Le travail ouvrira des portes pour intégrer des cellules conçues pour produire des matériaux minéralisés avec des caractéristiques structurelles et vivantes.
Minéralisation contrôlable dans l'espace de biofilms inductibles par la lumière pour des composites à motifs vivants. (a) Schéma de la configuration expérimentale et étapes séquentielles pour produire des composites à motifs vivants. Le motif de feuille bleu représenté dans l'illustration a été projeté sur une boîte de Pétri contenant la souche lightreceiver-CsgA-Mfp3S-pep en suspension dans le milieu. La lumière bleue déclenche la formation de biofilm fonctionnel grâce à l'expression régulée par la lumière des protéines CsgA-Mfp3S-pep de la souche lightreceiver-CsgA-Mfp3S-pep. Le milieu de culture dans la boîte de Pétri a ensuite été remplacé par du SBF 1.5x, suivi d'une incubation à 37°C pour former des composites. Après le processus de minéralisation, aTc a été ajouté pour induire l'expression d'une protéine fluorescente rouge (mCherry). (b) Image d'appareil photo numérique des biofilms à motifs colorés avec CV. Barre d'échelle, 1 cm. (c) Images SEM montrant la morphologie de surface des biofilms à motifs. Barres d'échelle :2 µm (gauche), 1 µm (à droite). (d) Image d'appareil photo numérique du composite minéralisé subséquent qui a conservé le motif d'origine. Barre d'échelle, 1 cm. (e) Images SEM montrant les microstructures de surface du composite minéralisé. Barres d'échelle :2 µm (gauche), 1 µm (à droite). (F, g) Analyse confocale par microscopie à balayage laser de la viabilité bactérienne dans les biofilms (f) et les composites (g). Barres d'échelle, 5 µm. Notez que le colorant SYTO 9 et le PI ont été appliqués comme agents de marquage pour colorer les cellules vivantes (vertes) et mortes (rouges), respectivement. (h) Fluorescence induite du composite vivant enregistré avec un système ChemiDoc XRS. Barre d'échelle, 1 cm. je, La microscopie confocale a démontré l'expression de mCherry à partir des bactéries dans le composite. Barre d'échelle, 20 µm. j, Images confocales d'un composite vivant après induction de l'expression de mCherry et marquage à la calcéine, qui a indiqué une distribution homogène des composants organiques et des minéraux inorganiques à l'intérieur des composites vivants à motifs. Barres d'échelle, 20 µm. Crédit: Nature Chimie Biologie , doi :https://doi.org/10.1038/s41589-020-00697-z 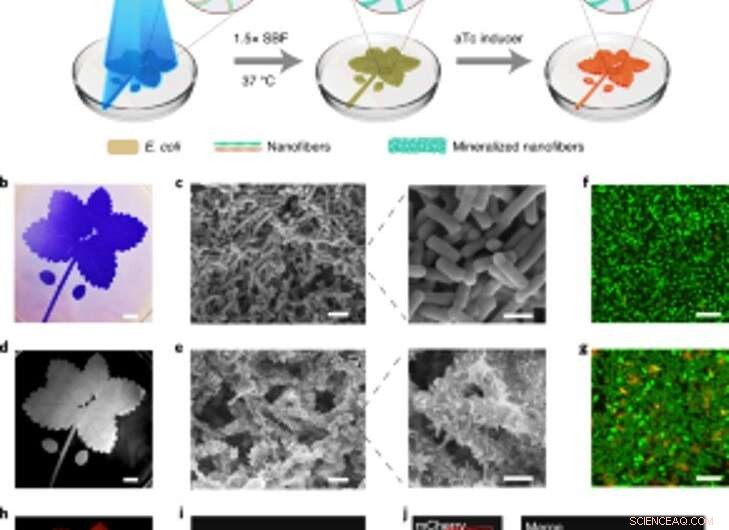
L'équipe a sélectionné des protéines de fusion pour concevoir la minéralisation favorisant les biofilms d'E. coli. Sur la base d'expériences précédentes, ils ont sélectionné la protéine Mefp5 – provenant de Mytilus edulis, suivi de Mfp3S - provenant de Mytilus californianus et d'une autre variante du peptide Mfp3S (Mfsp3S-pep) pour initier la minéralisation et favoriser l'adhésion. L'équipe a construit des protéines de fusion contenant un domaine protéique majeur du biofilm d'E. coli pour former des protéines de fusion CsgA-Mfp et a confirmé leur sécrétion potentielle à partir de cellules modifiées. Ils ont ensuite sélectionné la protéine de fusion CsgA-Mfp3S-pep comme représentante de la minéralisation de l'hydroxyapatite et mené des expériences pour vérifier la fonction de la protéine afin de mettre en évidence son rôle lors de la minéralisation et de la formation de cristaux. Après, Wang et al. construit une souche formant un biofilm inductible par la lumière nommée lumière
La souche photosensible pourrait générer des matériaux de biofilm fonctionnels après éclairage avec de la lumière pour favoriser la minéralisation de l'hydroxyapatite (HA). Pour valider cela, les scientifiques ont exposé la souche photosensible à la lumière bleue dans une boîte de Pétri et ont utilisé la coloration histologique et l'imagerie par microscopie électronique à transmission (MET) pour montrer la production de fibres amyloïdes dans les biofilms. Relativement, ils n'ont pas observé de fibres amyloïdes dans des échantillons cultivés dans l'obscurité. La matrice extracellulaire modifiée a également agi comme un modèle pour la minéralisation de HA dans le temps, ce qu'ils ont confirmé après 7 jours d'incubation sur la base des techniques de diffraction des rayons X (XRD) et de spectroscopie des rayons X à dispersion d'énergie (EDS).
Minéralisation à densité contrôlable dans des biofilms à gradient d'intensité lumineuse utilisés pour fabriquer des composites vivants gradués. (a) Illustration schématique montrant la génération de composites vivants à gradient grâce à la minéralisation in situ de biofilms avec des densités de biomasse à gradient. Les biofilms de gradient ont été formés en projetant de la lumière avec des intensités variables et un contrôle spatial précis sur la boîte de Pétri contenant la souche lightreceiver-CsgA-Mfp3S-pep suspendue dans le milieu. (b) Image d'appareil photo numérique montrant des biofilms colorés par CV avec des densités de biomasse en gradient. Barre d'échelle, 1 cm. (c) Image d'appareil photo numérique de composites vivants à gradient formés par la suite après la minéralisation HA. Barre d'échelle, 1 cm. (d) L'épaisseur des biofilms et des composites minéralisés par la suite formés sous différentes intensités lumineuses. Les résultats sont présentés sous forme de moyenne ± s.d. Les données sont représentatives de n= 5 expériences indépendantes. (e) Micrographies SEM en coupe montrant les morphologies de différentes régions (A1-A4) dans les biofilms à intensité lumineuse. Barres d'échelle, 10 µm. L'image en médaillon (prise de la région A4) représente la morphologie de surface typique des biofilms. Barre d'échelle, 1µm. (f) Micrographies SEM en coupe montrant les morphologies de différentes régions (B1-B4) dans les composites à gradient vivant telles que modélisées par des échafaudages de biofilm à intensité lumineuse. Barres d'échelle, 10 µm. L'image en médaillon (prise de la région B4) représente la morphologie de surface typique des composites à gradient minéralisé. Barre d'échelle, 1µm. Notez que les pourcentages d'opacité de 100%, 50%, 25% et 12.5% correspondent à des intensités lumineuses réelles de 0,0306 W cm-2, 0,0268 W cm-2, 0,0178 W cm-2 et 0,0140 W cm-2, respectivement. Crédit: Nature Chimie Biologie , doi:10.1038/s41589-020-00697-z 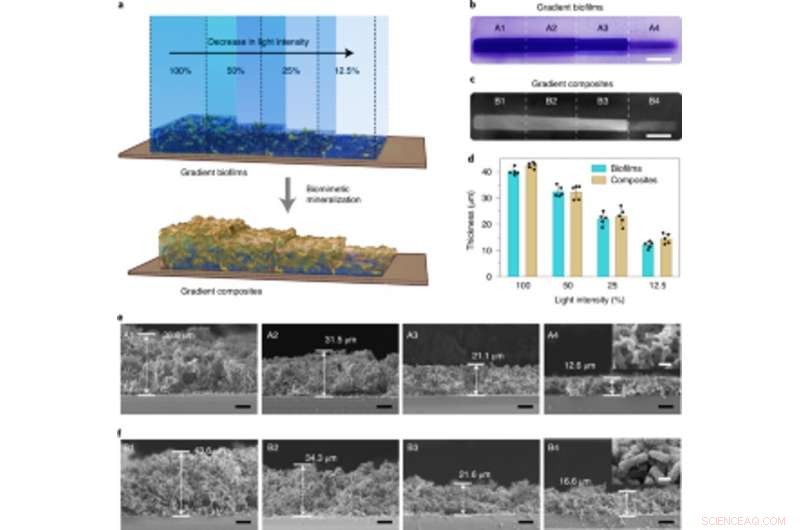
Sur la base de la nature sensible à la lumière des biofilms fabriqués, Wang et al. formation de biofilm manipulé dans l'espace-temps pour contrôler la formation de composites. Ils y sont parvenus en éclairant un motif de feuille sur des cultures bactériennes liquides dans des boîtes de Pétri en polystyrène qui récapitulaient fidèlement le motif lumineux projeté sur les biofilms bactériens. Après 7 jours de minéralisation, le composite généré dans les boîtes de Pétri a conservé le motif original tel qu'observé en utilisant la microscopie électronique à balayage. L'approche régulée par la lumière contrôlait la forme du composite sur la base de projections de grille et d'une résolution spatiale de la lumière à l'échelle microscopique, comparable à la taille des bactéries vivantes. L'équipe a ensuite vérifié la viabilité du live, cellules intactes en manipulant les composites vivants pour exprimer des protéines fluorescentes, comme confirmé en utilisant des images de microscopie confocale. Après, ils ont utilisé l'analyse thermogravimétrique pour quantifier les composants inorganiques des composites minéralisés, où la matière inorganique a augmenté proportionnellement avec le temps d'immersion dans un fluide corporel simulé (SBF). Wang et al. ont également comparé le module de Young du biofilm en utilisant une technique de micro-indentation pour montrer comment la minéralisation renforçait les biofilms d'E. coli pour protéger les cellules.
Composites à gradient de densité contrôlé
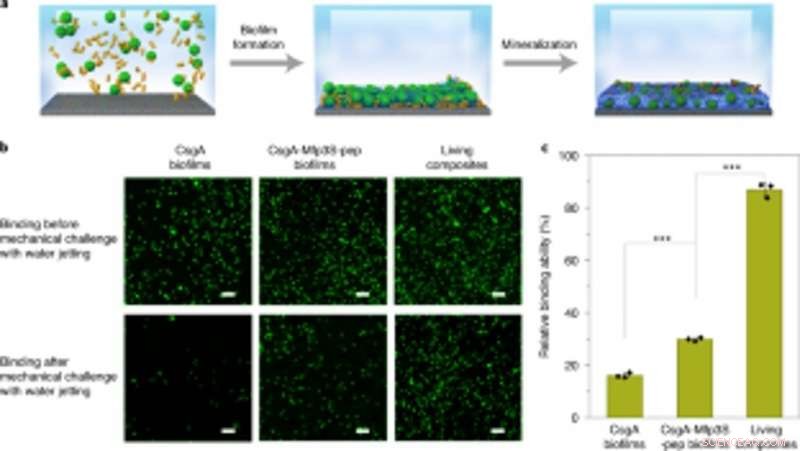
Couplage de biofilms artificiels avec minéralisation pour une capture et une immobilisation robustes de microsphères sur des substrats. (a) Schéma montrant la capture et l'immobilisation de microsphères sur une lame de verre en solution. Des microsphères de PS en suspension dans un milieu de culture ont été capturées et immobilisées sur un substrat par formation de biofilm suivie d'une minéralisation dans 1,5 × fluide corporel simulé (SBF). (b) Images fluorescentes montrant les deux types de biofilms (colonnes de gauche et du centre) et les microsphères vivantes composites immobilisées (colonne de droite) sur les substrats avant (en haut) et après (en bas) le défi avec un jet d'eau à une pression de décharge constante de 8 psi. Barres d'échelle, 100 µm. (c) Quantification des capacités relatives de différents biofilms et composites vivants à coller et immobiliser des microsphères de PS sur le substrat. Les résultats sont présentés sous forme de moyenne ± s.d. De gauche à droite :P= 0.00003, P= 0,000004. *P < 0,05, **P < 0,01, ***P < 0,001. Les statistiques sont dérivées à l'aide d'un test t bilatéral. Les données sont représentatives de n= 3 expériences indépendantes. Crédit: Nature Chimie Biologie , doi :https://doi.org/10.1038/s41589-020-00697-z
Les approches d'ingénierie tissulaire ont souligné la nécessité d'identifier avec précision entre les tissus durs et mous pour une performance physiologique réussie, par conséquent, l'intensité lumineuse pourrait être réglée pour contrôler la densité et les propriétés mécaniques des matériaux vivants d'ingénierie. Zhang et al. accompli cela en exposant des cultures d'E. coli à différentes intensités d'éclairage pour révéler comment l'épaisseur du biofilm diminuait avec la diminution de l'intensité de la lumière bleue. Ils ont en outre montré comment la minéralisation était étroitement et localement dirigée par les protéines de fusion Mfsp3S-pep. Ensuite, ils ont étudié les propriétés mécaniques locales des régions illuminées avec micro-indentation pour observer une multiplication par quatre du module de Young afin de mettre en évidence des composites vivants conçus avec des gradients minéraux et des propriétés mécaniques réglables pour les interfaces tissu-os régénératrices dans les applications d'ingénierie tissulaire osseuse.
Déploiement de composites vivants pour la réparation des dommages spécifiques au site
Les scientifiques ont également étudié la capacité des biofilms fabriqués à s'agréger pour réparer les dommages en collant des microsphères de polystyrène, parallèlement à la minéralisation HA. Comme preuve de concept, ils ont appliqué des composites minéralisés vivants pour combler et réparer les fissures créées à la surface d'une boîte de Pétri en polystyrène. Lors des expérimentations, les biofilms adhésifs photo-induits ont capturé des microsphères en solution pour combler le sillon endommagé créé à dessein, tandis que les nanofibres dans les biofilms ont servi de modèle pour la minéralisation de l'hydroxyapatite afin de consolider la cimentation induite par la lumière sous un éclairage en lumière bleue. En utilisant la microscopie électronique à balayage, Wang et al. ont montré comment les bactéries et la matrice extracellulaire environnante adhèrent aux microsphères pour illustrer la fonction adhésive des biofilms vivants. Les composites HA-minéralisés ont formé dense, des couches ressemblant à du béton qui ont déposé le sillon endommagé pour mettre en évidence la fonctionnalité de minéralisation des composites vivants pour une durabilité améliorée et des applications de réparation.
Application d'une minéralisation vivante contrôlable pour les réparations de dommages spécifiques au site. (a) Schéma montrant l'application de composites minéralisés vivants pour remplir et réparer les fissures à la surface d'une boîte de Pétri PS. De gauche à droite :sillon d'endommagement sur le substrat de la boîte de Pétri, les biofilms adhésifs photo-induits capturent les microsphères en solution pour combler le sillon endommagé, et les nanofibres dans les biofilms agissent comme un modèle pour la minéralisation HA pour consolider le ciment. (b) Image SEM montrant le sillon de dommages. Au dessous de, un schéma de principe illustrant les dimensions du sillon d'endommagement. Barre d'échelle, 50µm. c, Images SEM montrant la morphologie du sillon endommagé rempli du biofilm et des microsphères. Barres d'échelle :50 µm (en haut), 5 µm (en bas). (d) Images SEM montrant la morphologie du sillon d'endommagement après minéralisation; HA comble les vides entre les sphères. Barres d'échelle :50 µm (en haut), 5 µm (en bas). Notez que les expériences de réparation des dommages spécifiques au site ont été répétées au moins trois fois avec des résultats identiques. Crédit: Nature Chimie Biologie , doi:10.1038/s41589-020-00697-z 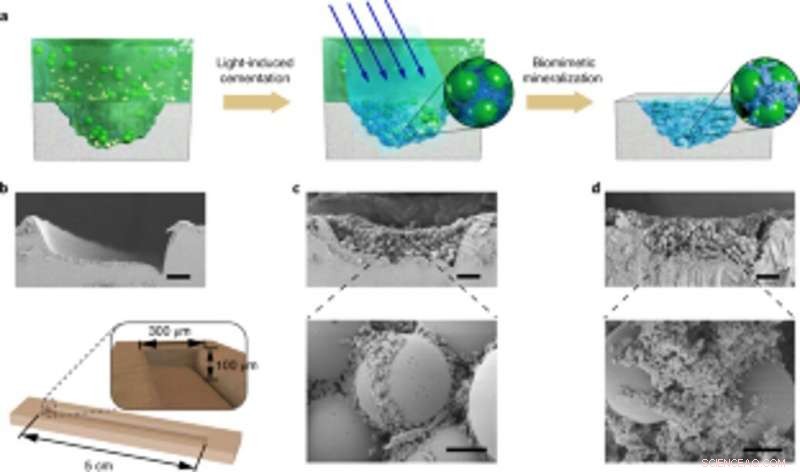
De cette façon, Yanyi Wang et ses collègues ont produit des composites vivants à motifs bioinspirés et des composites vivants gradués avec une plate-forme de biofilm régulée par la lumière. Les composites résultants ont affiché une réactivité environnementale similaire à leurs homologues natifs. Les cellules des composites sont restées viables et ont répondu aux stimuli environnementaux même après la minéralisation. L'œuvre ouvre une voie pour créer du vivant, des composites organiques-inorganiques fonctionnels dotés de caractéristiques adaptatives et autoréparatrices avec des applications en biomédecine, médecine régénérative, et la bioremédiation.
© 2020 Réseau Science X