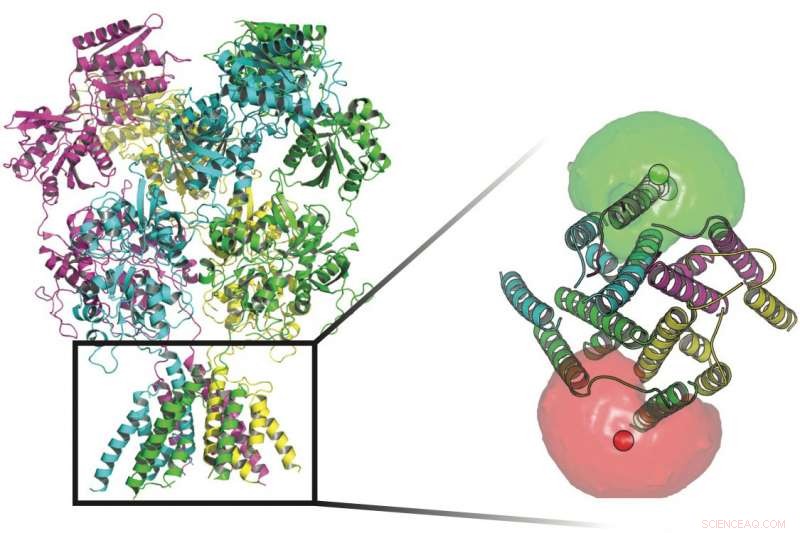
Des scientifiques de l'Université Rice et de l'UTHealth ont suivi les conformations des protéines qui montent la garde au niveau des canaux transmembranaires dans les parois des cellules nerveuses. À la base des protéines de cette image se trouvent des fluorophores (sphères rouges et vertes) entourés de nuages de fluorophores qui ont aidé les chercheurs à définir les mouvements de la porte qui permet aux ions de traverser la membrane. Crédit :Université Rice/UTHealth
La capacité de suivre les mouvements de molécules individuelles a révélé comment les protéines à la surface des cellules nerveuses contrôlent les portes qui transforment les signaux chimiques en signaux électriques. Cette découverte est un pas en avant dans la description détaillée des mécanismes impliqués dans les maladies neurologiques, selon des chercheurs de l'Université Rice et du Centre des sciences de la santé de l'Université du Texas à Houston (UTHealth).
En utilisant des méthodes d'imagerie et statistiques sophistiquées, les scientifiques ont utilisé des techniques d'imagerie FRET à molécule unique pour établir une tête de pont à la porte du récepteur NMDA qui, lorsqu'il est activé, permet aux ions de traverser la membrane de la cellule nerveuse.
FRET signifie Förster Resonance Energy Transfer. C'est une façon d'utiliser la lumière émise par deux molécules fluorescentes marquées comme règle sensible pour de très petites distances, comme l'ouverture dans le canal récepteur NMDA.
La chimiste du riz Christy Landes, un expert en FRET monomoléculaire, et Vasanthi Jayaraman, professeur de biochimie et de biologie moléculaire à la McGovern Medical School d'UTHealth, dont l'expertise est en biochimie des récepteurs NMDA, se sont associés pour rassembler les premières preuves expérimentales détaillant la dynamique de la façon dont les récepteurs modifient leurs formes pour contrôler la sensibilité de la porte aux signaux chimiques. La nouvelle étude paraît dans Nature Chimie Biologie .
Le récepteur NMDA est composé de quatre sous-unités protéiques, chacun avec quatre domaines, et chacun de ces domaines a une fonction particulière. Collectivement, ils traversent la membrane cellulaire. Chaque sous-unité peut avoir plusieurs "états, " ou des formes, qui régulent quels signaux électriques - et combien d'entre eux - passent à travers. Les sous-unités se trouvent de chaque côté du canal et s'activent lorsqu'elles se lient à la fois aux ligands des neurotransmetteurs glutamate et glycine et déclenchent la voie de signalisation qui permet aux ions chargés positivement de passer dans la cellule.
"Ces récepteurs sont essentiels au fonctionnement physiologique normal, " Jayaraman a déclaré. "Souvent, vous ne voudrez peut-être pas activer ou désactiver la signalisation. Vous voudrez peut-être régler l'étendue de la signalisation. Une fois que nous comprenons tous les états de la protéine, nous pouvons commencer à réfléchir à des moyens de le faire, gardant ainsi la protéine active mais à des degrés divers selon les besoins.
"Il est important pour le développement de médicaments de comprendre ces dynamiques car les mouvements et les propriétés énergétiques de ces protéines dictent leurs fonctions spécifiques, " dit-elle. " Nous avons pu faire les deux. "
Cette connaissance pourrait conduire à des médicaments multifonctionnels qui influencent les canaux de manière subtile, dit Landes. Les antagonistes des récepteurs NMDA connus comprennent les anesthésiques courants, les opioïdes synthétiques comme la méthadone et les drogues dissociatives comme la kétamine et le protoxyde d'azote. La fonction déprimée des récepteurs NMDA est suspectée dans les déficits de mémoire couramment associés au vieillissement. L'alcool est connu pour inhiber le glutamate, l'un des deux neurotransmetteurs qui se lient au NMDA.

Les quatre sous-unités des protéines réceptrices NMDA peuvent chacune avoir de nombreux états qui régulent les signaux électriques qui traversent la membrane d'une cellule nerveuse. Les sous-unités s'activent lorsqu'elles se lient à la fois aux ligands des neurotransmetteurs glutamate et glycine et déclenchent la voie de signalisation qui permet aux ions chargés positivement de passer dans la cellule. Crédit :Université Rice/UTHealth
"Beaucoup de conception de médicaments a pour principe de base qu'il y a une façon de lier, et en gros, vous allumez ou éteignez quelque chose, " Landes a déclaré. "Mais il est évident que ce type de protéine réceptrice n'est pas seulement activé ou désactivé. Il existe de multiples interactions conformationnelles qui améliorent ou dégradent la signalisation."
Dans une étude antérieure, l'équipe a analysé les conformations d'un système plus petit et plus simple mais apparenté, le domaine de liaison agoniste de type C-clamp d'un autre récepteur, AMPA. L'AMPA assure la transmission rapide du signal dans le système nerveux central. La technique FRET à molécule unique a permis aux chercheurs d'obtenir les premiers instantanés des différentes conformations de pince de la protéine AMPA au repos et également lorsqu'elle est liée à une gamme de molécules cibles en mesurant la distance entre deux marqueurs moléculaires activés par la lumière.
Cette fois, les chercheurs ont cherché à comprendre l'ouverture du canal lui-même - comment les protéines qui composent le canal du récepteur NMDA se déplacent pour activer la porte ionique. En ajoutant des balises fluorescentes à travers le canal et en les échantillonnant au fil du temps, ils ont pu cartographier le paysage énergétique du segment transmembranaire de la protéine dans son état de repos ou sous l'influence de ligands qui modulent la grille entre ouvert, états fermés et intermédiaires. L'état structurel de chaque canal influence directement les signaux électriques autorisés à passer.
Ils ont découvert que l'état sans agoniste (au repos) est structurellement rigide, ce qui a confirmé sa résistance énergétique à adopter des conformations permettant l'ouverture des canaux. Les agonistes comme le glutamate sont les produits chimiques cibles qui déclenchent le transport du signal électrique à travers le canal. Les chercheurs ont confirmé qu'en présence de l'agoniste primaire, le canal NMDA était moins rigide et donc capable de passer plus facilement entre les conformations possibles à canal ouvert.
Le travail a également montré comment deux modulateurs connus pour interagir avec différentes parties de la conformation et de la rigidité du canal d'impact complet du récepteur. ions zinc, malgré la liaison à la partie extracellulaire du récepteur éloignée du canal, induire un canal raide avec des barrières énergétiques importantes à l'ouverture, similaire à l'état de repos du récepteur. En revanche, la dizocilpine « bloqueur de pores » s'est avérée améliorer l'énergétique des transitions entre de multiples conformations qui ne sont pas liées à l'ouverture des canaux.
Landes a dit que plutôt que de capturer des états statiques, comme c'est généralement le cas avec les rayons X, "Nous examinions les changements de distance à travers la Manche de manière dynamique. C'est beaucoup plus compliqué." Cela leur a donné un ensemble de données plus proche d'un film que d'un instantané, elle a dit.
Elle a déclaré que l'étude nécessitait de nouvelles techniques pour purifier et stabiliser les protéines complètes, qui ont été tirés des neurones de rongeurs. « Il y avait trois éléments clés dans ce projet :la manipulation des protéines complètes, les purifier et les étiqueter au niveau du récepteur unique et effectuer l'analyse des données pour découvrir ce que cela signifie.
"C'est vraiment le fondement ici, " dit-elle. " Maintenant, nous pouvons faire ces mesures pour des systèmes beaucoup plus compliqués. "