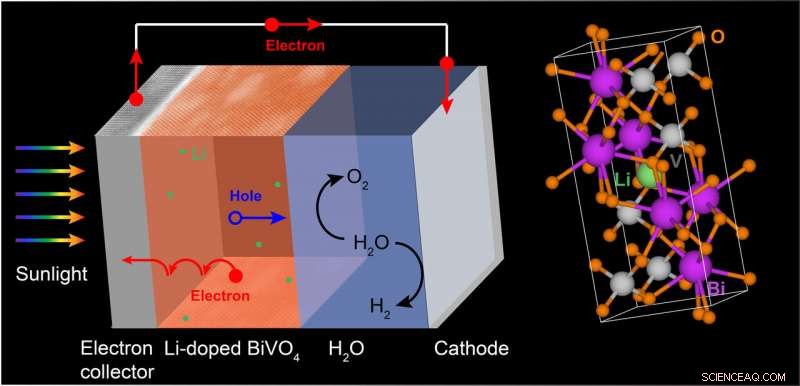
(À gauche) Sous la lumière du soleil, le vanadate de bismuth (BiVO4), un matériau d'électrode prometteur pour la séparation de l'eau, génère des paires électron-trou (porteurs de charge) pour séparer l'eau en hydrogène et oxygène gazeux. Par "dopage, " ou en combinant, vanadate de bismuth avec lithium (Li), les scientifiques ont augmenté la conductivité électrique et l'activité d'oxydation de l'eau du matériau. Oxydation de l'eau, qui génère de l'oxygène gazeux, est l'une des deux réactions de fractionnement de l'eau ; la deuxième réaction génère de l'hydrogène gazeux, un carburant. (À droite) Un modèle atomique de BiVO4 dopé au Li montre un atome de Li (vert) occupant un vide dans le réseau. Crédit :Laboratoire national de Brookhaven
Le soleil est une source abondante d'énergie renouvelable, qui peut être capté et converti en électricité utilisable. Cependant, parce que le soleil ne brille pas toujours, l'approvisionnement en énergie n'est pas continu. Nous avons besoin d'un moyen de stocker l'énergie du soleil afin qu'elle puisse être libérée à la demande pendant les périodes "off", comme la nuit et par temps nuageux.
Une option consiste à utiliser l'énergie solaire pour alimenter des réactions chimiques qui génèrent des carburants. Par exemple, l'énergie solaire peut être convertie en hydrogène, un combustible à forte densité énergétique et à combustion propre, grâce à la séparation de l'eau. Pour conduire cette réaction, deux électrodes en matériaux semi-conducteurs absorbant la lumière sont connectées et immergées dans l'eau. La lumière du soleil frappant les électrodes crée un courant électrique qui divise l'eau en ses deux composants :l'hydrogène et l'oxygène.
"Nous avons besoin de low-cost, largement disponible, et des semi-conducteurs respectueux de l'environnement qui peuvent absorber la lumière sur une gamme de longueurs d'onde et effectuer efficacement l'oxydation de l'eau en oxygène gazeux, la partie la plus difficile de la réaction, " a expliqué Mingzhao Liu, membre du personnel scientifique de l'Interface Science and Catalysis Group du Center for Functional Nanomaterials (CFN) du Brookhaven National Laboratory du Département de l'énergie des États-Unis (DOE). "Lorsqu'il est exposé à l'oxygène, les semi-conducteurs peuvent facilement se corroder."
Par exemple, silicium, le semi-conducteur généralement utilisé dans les cellules solaires, se corrode rapidement lorsqu'il est exposé à l'oxygène. Le dioxyde de titane a montré une stabilité et une conductivité électrique élevées, mais il n'absorbe que la lumière ultraviolette (UV), qui ne représente qu'environ six pour cent de tout le rayonnement solaire reçu à la surface de la Terre. Un autre candidat prometteur est le vanadate de bismuth. Fait de bismuth, vanadium, et l'oxygène (BVO), cette couleur jaune, le matériau non toxique a une grande stabilité et peut absorber à la fois les UV et la lumière visible. Cependant, c'est un mauvais conducteur d'électricité, limitant son efficacité de conversion solaire en hydrogène.
Au cours des dernières années, Liu a mené un effort pour développer un BVO de haute qualité et améliorer ses performances pour la division solaire de l'eau. Comme Liu l'a expliqué, Le BVO est un matériau compliqué car il est composé de deux métaux différents et d'oxygène. Si les rapports des atomes ne sont pas exactement un pour un, des défauts peuvent être introduits involontairement. Ces défauts rendent difficile l'étude des véritables propriétés du matériau et la découverte de ses limites inhérentes.
Pour créer des films minces de BVO avec une grande pureté et une structure cristalline, Liu utilise le dépôt laser pulsé. Dans cette technique, un laser UV focalisé chauffe un matériau cible avec la composition élémentaire souhaitée à l'intérieur d'une chambre à vide. Parce que l'énergie des impulsions laser est très intense, les atomes à la surface du matériau cible se vaporisent et se condensent sur un substrat pour former un film mince.
"Une fois que nous avons un matériau cristallin sans défaut, alors on peut demander, comment pouvons-nous l'améliorer ?", a déclaré Liu.
Dans une étude publiée plus tôt cette année, Liu, collègues du CFN, et des théoriciens de l'Université de Californie (UC), Santa Cruz, ont étudié comment la conductivité électrique du BVO pouvait être améliorée en y ajoutant de petites quantités d'autres matériaux (un processus connu sous le nom de dopage) via un dépôt laser pulsé. Les calculs de structure électronique des théoriciens ont indiqué que le lithium serait un dopant idéal à tester expérimentalement; le lithium contribuerait facilement un électron au système à température ambiante et serait suffisamment petit pour s'adapter à l'intérieur des vides du réseau sans affecter de manière significative sa structure.
Après avoir synthétisé des couches minces BVO dopées avec une quantité optimale de lithium, l'équipe a mené une série d'études de caractérisation à base d'électrons et de rayons X au CFN et à la source nationale de lumière synchrotron II de Brookhaven (NSLS-II). Ces études ont confirmé la pureté des films et l'absence de distorsions du réseau suite au dopage au lithium. Puis, l'équipe a mesuré les propriétés de transport électronique et les performances photoélectrochimiques du BVO dopé au lithium. D'après ces expériences, le dopage au lithium a augmenté la conductivité du BVO de près de deux ordres de grandeur et son activité d'oxydation de l'eau de 20 pour cent, par rapport au BVO pur.
"La prédiction de la théorie et la validation expérimentale vont de pair pour créer rapidement de nouveaux matériaux pour la conversion d'énergie, " dit Yuan Ping, professeur adjoint au département de chimie et de biochimie et chercheur principal du groupe Ping à l'UC Santa Cruz.
Dans une autre étude récente, Liu et ses collaborateurs de l'Université de Chicago et de l'Université du Wisconsin-Madison ont étudié l'impact des lacunes d'oxygène sur la structure électronique et les propriétés de transport du BVO dans son orientation la plus énergétiquement stable. Comme Liu l'a expliqué, les sites du réseau où l'oxygène manque sont inhérents aux matériaux oxydes, même sans dopage. En utilisant des méthodes de calcul, l'équipe a créé un modèle structurel de BVO et validé ce modèle en comparant les états électroniques calculés et expérimentaux. Leurs résultats suggèrent que les lacunes d'oxygène dans la masse (à l'intérieur) du matériau contribuent à la conductivité, tandis que ceux à la surface ne le font pas et peuvent en fait entraver la conductivité.
"Les lacunes d'oxygène à la surface agissent plutôt comme des pièges à charge, " dit Liu. " Quand les charges vont là-bas, ils deviennent localisés et coincés."
Des études de suivi sont nécessaires pour comprendre comment les lacunes d'oxygène à la surface et leur tendance à immobiliser les charges sont affectées lorsque le BVO est immergé dans l'eau et travaille en conjonction avec un co-catalyseur pour améliorer le transfert de charge. Les scientifiques étudieront si les oxydes de métaux de transition peuvent fonctionner efficacement comme co-catalyseurs. Ils exploreront également comment l'activité de séparation de l'eau solaire dépend du type d'atomes (bismuth ou vanadium) qui terminent la couche de surface.
« Dans les deux études, les collaborations étroites entre expérimentateurs et théoriciens ont été la clé de notre succès, " a déclaré Liu. " Nous sommes impatients de poursuivre ces collaborations pour élargir davantage notre compréhension de BVO et identifier des mécanismes pour améliorer ses performances. "