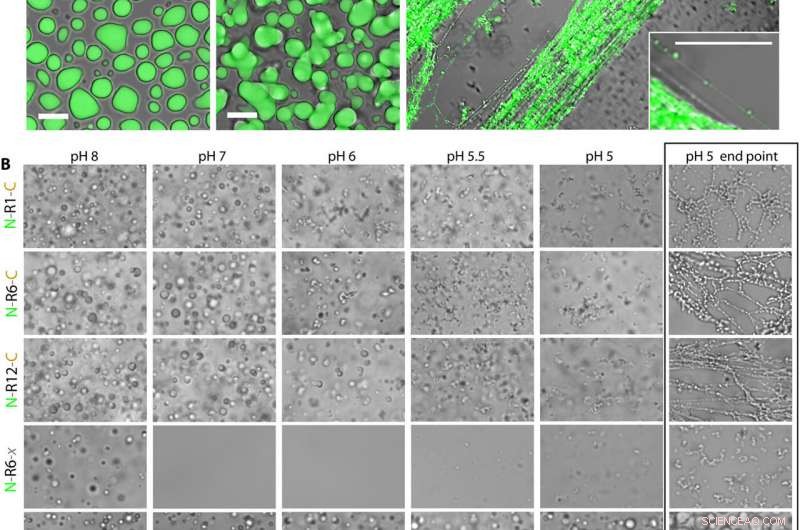
L'acidification déclenche l'auto-assemblage rapide des nanofibrilles MaSp2. (A) N-R12-C marqué avec DyLight 488 (10 à 20 mg ml-1 concentration finale) a été mélangé dans 0,5 M KPi aux valeurs de pH indiquées et visualisé par microscopie confocale à balayage laser. Lors du mélange des composants, MaSp2 rapidement séparé de la fraction aqueuse (structures vertes), finir par se déposer sur la surface du verre. A pH 7 et 8, les condensats MaSp2 apparaissent sous forme de gouttelettes LLPS en fusion dynamique, alors qu'à pH 6, les structures résultantes sont statiques avec un aspect semi-solide. La réaction à pH 5 conduit à un auto-assemblage rapide de MaSp2 en fréquemment alignés, réseaux de fibrilles étendus. L'encart montre une fibrille individuelle à pH 5 avec un diamètre de ~ 100 nm. Barres d'échelle, 10 µm. (B) Différentes constructions MaSp2 ont été évaluées pour leur capacité à subir un auto-assemblage de fibrilles induit par le phosphate et par le pH. Du MaSp2 purifié (concentration finale de 150 M) a été mélangé à une goutte de 0,5 M de KPi aux valeurs de pH indiquées sur une lame de verre. Toutes les images dans la région non encadrée (à gauche) ont été prises dans les 30 s suivant le mélange. La zone encadrée à droite montre le point final des réactions pH 5, prise 30 min après l'initiation. Toutes les images ont été prises à la même échelle; barre d'échelle, 10 µm. Crédit: Avancées scientifiques (2020). DOI :10.1126/sciadv.abb6030
Une équipe de chercheurs du RIKEN Center for Sustainable Resource Science, Université Keio et Université de Kyoto, a découvert que la séparation de phase liquide-liquide (LLPS) entraîne le processus de conversion des protéines de spidroïne en fibres de toile d'araignée. Dans leur article publié dans la revue Avancées scientifiques , le groupe décrit la réplication du processus de conversion d'une protéine interne en fibres de toile d'araignée dans leur laboratoire et comment cela leur a permis de créer des brins de soie.
Les scientifiques étudient les araignées et les toiles qu'elles créent depuis de nombreuses années, dans le but de reproduire le procédé et ainsi d'industrialiser la production de soie. Malheureusement, malgré beaucoup d'efforts, les scientifiques ne savent toujours pas comment les araignées le font. Ils savent que les araignées créent des protéines de spidroïne, qu'ils gardent dans un sac jusqu'à ce qu'ils soient prêts à faire une toile. Puis, lorsqu'ils éjectent les protéines liquides, le matériau se transforme en quelque sorte automatiquement en fibres pour créer des brins. Dans ce nouvel effort, les chercheurs ont trouvé un moyen de reproduire une partie de ce processus.
Le travail consistait à concevoir des bactéries pour produire le type de protéines de spidroïne normalement produites par l'araignée Joro. En étudiant la protéine, ils ont découvert qu'il devenait trouble lorsqu'il était exposé à des températures chaudes. Un examen plus attentif a montré que la protéine était en train de fusionner et de fusionner, une première étape probable vers le processus de formation des fibres. Ils ont également constaté que le processus impliquait LLPS.
L'équipe a ensuite essayé d'exposer la protéine à différents matériaux jusqu'à ce qu'elle tombe sur le phosphate, ajoutant que cela rendait également la protéine trouble. L'équipe a ensuite commencé à ajuster le mélange de protéines en modifiant les niveaux de pH jusqu'à ce que le mélange commence à créer des fibres. Ils découvrirent ensuite que pour faire un brin, tout ce qu'ils avaient à faire était d'étirer le matériau chargé de fibres. Cela leur a permis de créer un brin de 10 centimètres de long. L'étude du brin au microscope a montré qu'il avait la même structure que les brins produits naturellement par les araignées.
Les chercheurs notent que leur travail n'est qu'une étape provisoire vers une compréhension complète du processus par lequel les araignées créent de la soie. Ils prévoient de faire avancer leurs recherches dans le but ultime de développer un moyen de produire de la soie en laboratoire, ou une usine.
© 2020 Réseau Science X