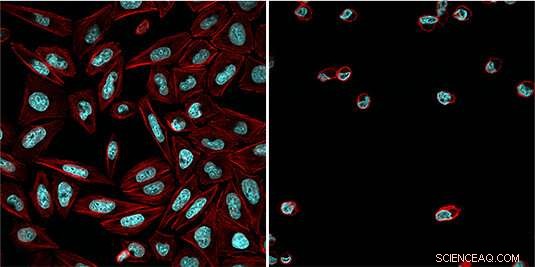
Cellules traitées par l'inhibiteur photodépendant (cytosquelette d'actine en rouge, ADN en bleu) après exposition à la lumière bleue (à droite) et sans activation du rayonnement de lumière bleue (à gauche). Crédit :Esther Zanin
Les chercheurs de l'Université Ludwig Maximilian ont conçu un inhibiteur sensible à la lumière qui peut contrôler la division cellulaire et la mort cellulaire et fournit une approche prometteuse pour les études des processus cellulaires essentiels et le développement de nouvelles thérapies tumorales.
La capacité de contrôler avec précision les processus biologiques et chimiques est un élément essentiel à la fois de la recherche fondamentale et de la médecine. La lumière représente un stimulus attractif dans ce contexte, car ses effets peuvent être modulés avec précision à la fois spatialement et temporellement. Ces propriétés souhaitables sont la raison pour laquelle le développement de molécules contrôlables par la lumière est devenu un objectif si important pour les chimistes biologiques. De tels outils promettent d'apporter des contributions significatives à l'élucidation des fonctions cellulaires de base, la compréhension détaillée des troubles médicaux et la conception de nouvelles stratégies thérapeutiques pour les combattre. Un groupe de chercheurs dirigé par la biologiste cellulaire Esther Zanin au Biocentre de LMU, en coopération avec le chimiste Henry Dube (qui a déménagé en avril de cette année du LMU à l'Université d'Erlangen-Nürnberg) a maintenant développé un inhibiteur chimique sensible à la lumière, qui leur permet de contrôler deux processus cellulaires fondamentaux, division cellulaire et mort cellulaire, avec lumière.
La division cellulaire est un processus vital et très complexe. Il est donc soumis à une réglementation stricte pour garantir que les cellules ne se divisent qu'au bon moment et sans erreur. Les cellules défectueuses sont éliminées par mort cellulaire programmée (également appelée « apoptose »). La division cellulaire correcte et l'élimination des cellules défectueuses dépendent d'une machine moléculaire appelée protéasome, qui dégrade spécifiquement les protéines cellulaires qui sont soit endommagées soit ne sont plus nécessaires.
"Nous avons maintenant modifié un inhibiteur chimique établi et polyvalent du protéosome en lui ajoutant un groupe protecteur photosensible, " dit Zanin. " Ce groupe bloque la fonction aldéhyde réactive de l'inhibiteur et l'empêche de se lier au protéasome. " Dans l'obscurité, l'inhibiteur est donc inactif et le protéasome fonctionne normalement. Cependant, l'exposition des cellules à la lumière bleue détache le groupe protecteur, permettant ainsi à l'inhibiteur d'interagir avec le protéosome et d'inhiber sa fonction. Étant donné que le rayonnement de lumière bleue d'activation peut être ciblé avec précision, l'action de l'inhibiteur peut être contrôlée très précisément. « Par ce moyen, nous sommes capables d'arrêter la division des cellules tumorales à un stade spécifique du processus, et déclencher l'apoptose de manière ciblée, " explique Zanin.
Elle et ses collègues pensent que le nouvel inhibiteur du protéosome photosensible s'avérera être un outil précieux pour l'étude d'un large éventail de processus cellulaires dynamiques, par exemple, dans le cadre du développement, au cours de laquelle les cellules et les tissus subissent des changements rapides et souvent radicaux pendant une courte période et dans des endroits confinés. En outre, les inhibiteurs de protéosomes ont des applications prometteuses en tant qu'agents thérapeutiques - dans le traitement du cancer, par exemple. « La capacité d'activer ces composés spécifiquement dans le temps et dans l'espace pourrait les rendre plus efficaces à l'avenir, tout en réduisant l'incidence des effets secondaires, " dit Zanin. Cependant, atteindre cet objectif nécessitera des travaux supplémentaires, car l'inhibiteur utilisé dans la nouvelle étude n'est pas adapté à un usage médical sous sa forme actuelle.