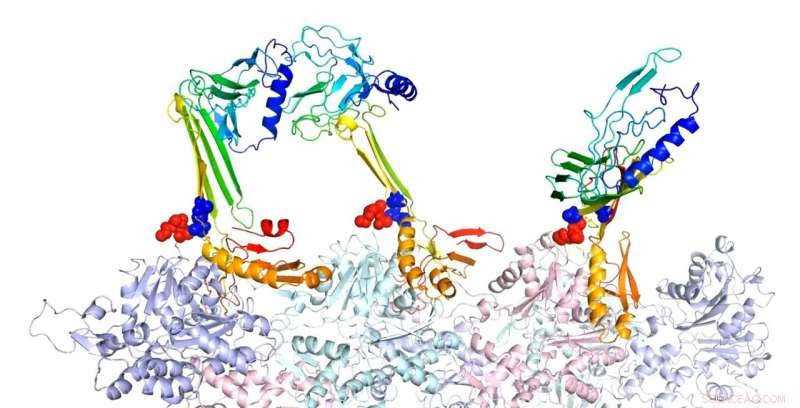
Des chercheurs de l'Université Rice ont modélisé les structures de liaison de l'actine et des protéines associées qui, selon eux, sont responsables de la formation de la mémoire à long terme. Ici, la forme en épingle à cheveux bêta de la séquence de fermeture à glissière est un noyau potentiel pour la formation de feuillets bêta intramoléculaires. Dans la structure complexe prédite de la F-actine et des trois constructions PRD+ABD présentées ci-dessus, les trois constructions PDB+ABD sont représentées en couleur arc-en-ciel, du bleu au rouge, de la borne N à la borne C. Les surfaces des 4 premiers résidus négatifs des monomères d'actine sont colorées en rouge et les surfaces des deux extrémités positives de la séquence de fermeture à glissière sont colorées en bleu. Crédit : Centre de physique biologique théorique/Université du riz
Une protéine caméléon dans les neurones peut changer d'avis, et dans le processus changer nos cerveaux.
Des scientifiques de l'Université Rice et du Centre des sciences de la santé de l'Université du Texas à Houston (UTHealth) ont découvert de nouveaux indices sur la protéine CPEB3 dans le cadre de leur poursuite acharnée du mécanisme qui permet aux humains d'avoir des souvenirs à long terme.
L'étude du biophysicien théorique de Rice Peter Wolynes et Neal Waxham, un neurobiologiste à la McGovern Medical School d'UTHealth, donne un aperçu d'une boucle de rétroaction positive entre la formation des squelettes d'actine qui donnent aux épines dendritiques leur forme et leur flexibilité et les domaines de liaison à l'actine dans CPEB3, un prion fonctionnel qui se lie à l'ARN qui forme également des agrégats à longue durée de vie qui peuvent en effet stocker la substance dont sont faits les souvenirs.
Les modèles de repliement des protéines de Wolynes et son groupe du Rice's Center for Theoretical Biological Physics (CTBP) et des expériences à UTHealth ont révélé des détails structurels jusqu'alors inconnus pour CPEB3 et comment il se lie à l'actine, comme indiqué dans le Actes de l'Académie nationale des sciences papier.
Dans le processus, ils ont également examiné le rôle clé joué par une protéine connue sous le nom de SUMO, un régulateur qui se fixe et se détache d'autres protéines dans les cellules pour modifier leurs fonctions. Les chercheurs pensent que cela aide à réguler quand et comment les extrémités caméléon de CPEB3 (l'extrémité N et l'extrémité C) se lient soit à SUMO, soit au flexible, épines d'actine filamenteuse (f-actine) dans des pointes dendritiques.
Les protéines CPEB3 sont solubles lorsqu'elles sont attachées à SUMO, qui enterre également leurs sites de liaison à l'actine. Mais pendant l'activité synaptique, ils peuvent être "déSUMOylés" et devenir disponibles pour se lier aux poches de liaison hydrophobes le long des filaments de f-actine.
Les modèles montrent que lorsqu'ils sont attirés par l'actine, CPEB3 passe d'une bobine d'hélices enroulées à une structure en feuillet bêta qui "se zippe" dans une configuration en épingle à cheveux qui lui permet de s'agréger avec d'autres protéines CPEB3.
Lors de l'agrégation, CPEB3 semble traduire ses ARN messagers cibles, qui incluent l'ARNm d'actine qui renforce les jonctions synaptiques essentielles à la mémoire, boucler la boucle positive.
"C'est un projet plus ambitieux que l'étude actine-CaM kinase, où nous avons également simulé un système d'actine vraiment énorme avec une protéine vraiment énorme, " a déclaré Wolynes. Dans cette étude, publié il y a un an, Les chercheurs du CTBP ont modélisé comment une protéine centrale (CaMKII) maintient ensemble des filaments d'actine parallèles, un état qui pourrait être visualisé au microscope électronique par le laboratoire de Waxham.
Maintenant, les chercheurs définissent les détails structurels qui permettent à CPEB3 de se lier à l'actine ou au SUMO, mais pas les deux. "L'un des principaux aspects de cet article est de réconcilier ces deux parties assez différentes de l'histoire, ", a-t-il déclaré. "Nous pensons que les terminaux CPEB ressemblent à des caméléons car ils laissent la molécule choisir si elle interagira avec le SUMO ou avec l'actine.
"Nous ne sommes pas encore à la fin de l'histoire, ", a déclaré Wolynes. "Mais les derniers résultats nous placent dans une position raisonnable pour en dire plus sur le mécanisme."