
Une LED bleue éclaire un flacon contenant de l'eau lourde, un composé pharmaceutique, et un catalyseur activé par la lumière. La nouvelle approche photocatalytique de David MacMillan de Princeton transforme un processus de plusieurs mois en une étape d'une journée, accélérer l'arrivée de nouveaux médicaments sur le marché. Crédit :David MacMillan/Université de Princeton
La radioactivité peut avoir mauvaise réputation, mais il joue un rôle essentiel dans la recherche médicale. Une nouvelle technique révolutionnaire pour créer des molécules radioactives, pionnier dans le laboratoire du professeur de chimie de Princeton David MacMillan, a le potentiel d'apporter de nouveaux médicaments aux patients beaucoup plus rapidement qu'auparavant.
"Votre médicament moyen met 12 à 14 ans pour arriver sur le marché, " dit MacMillan, le James S. McDonnell Distinguished University Professor of Chemistry. "Donc, tout ce que nous pouvons faire pour prendre ce délai de 14 ou 12 ans et le comprimer profitera à la société, parce qu'il achemine les médicaments aux gens – à la société – tellement plus rapidement. »
Chaque nouveau médicament potentiel doit subir des tests pour confirmer qu'il affecte la partie du corps qu'il est censé affecter. "Est-ce qu'il va au bon endroit ? Au mauvais endroit ? Au bon endroit et au mauvais endroit ?" demanda MacMillan.
Tracer le chemin d'un produit chimique qui se dissout dans la circulation sanguine a présenté un sérieux défi, mais celui que les radiochimistes ont résolu il y a des années en remplaçant des atomes individuels par des substituts radioactifs. Une fois cela fait, "les propriétés de la molécule—du médicament—sont exactement les mêmes sauf qu'elles sont radioactives, et cela signifie que vous pouvez les tracer vraiment, vraiment bien, " a déclaré MacMillan.
Mais cela a introduit un nouveau problème.
"Intégrer ces atomes radioactifs dans le médicament n'est pas une chose banale à faire, " dit-il. " Les gens se sont développés depuis longtemps, parfois un mois, deux mois, des séquences de trois mois juste pour obtenir une infime quantité d'une substance avec quelques atomes radioactifs."
Mais maintenant, lui et ses collègues ont trouvé un meilleur moyen, s'appuyant sur leur travail en utilisant des lumières LED bleues et des catalyseurs qui répondent à la lumière, appelés photocatalyseurs. Leurs recherches ont été publiées en ligne dans la revue Science le 9 novembre.
"C'était une idée farfelue ! Heureusement, ça a marché, " a déclaré MacMillan. " Ce que nous avons trouvé était, si tu les éclaires, ces photocatalyseurs pourraient-ils réellement éliminer l'atome non radioactif, puis installer l'atome radioactif ?"
Ils pourraient.
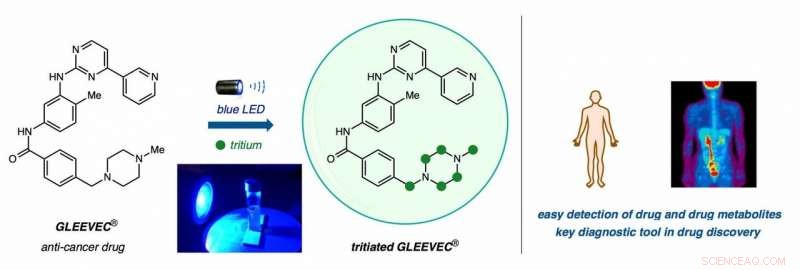
De gauche à droite : Gleevec, un médicament anticancéreux, est immergé dans de l'eau lourde (T2O) et baigné de lumière LED bleue pour remplacer les atomes d'hydrogène par des atomes de tritium (cercles verts) dans un échange direct d'isotopes d'hydrogène (HIE) en une étape. Les cliniciens peuvent tracer des composés radioactifs dans le corps à l'aide de technologies d'imagerie sophistiquées à des fins de recherche et de diagnostic. Crédit :Yong Yao Loh, Kazunori Nagao, et David MacMillan/Université de Princeton
La technique de MacMillan utilise « de l'eau lourde, " qui remplace l'hydrogène (H) dans H2O par du tritium, une version radioactive de l'hydrogène qui a deux neutrons supplémentaires par atome.
"Si vous laissez simplement votre médicament reposer dans l'eau radioactive et l'éclairer avec un catalyseur, le catalyseur va retirer l'atome qui n'est pas radioactif - dans ce cas c'est l'hydrogène - et le remplacer par du tritium, " il a dit.
Soudainement, attacher l'une de ces étiquettes atomiques prend des heures au lieu de mois, et la technique fonctionne sur de nombreux types de composés fréquemment utilisés. Les chercheurs l'ont déjà testé sur 18 médicaments disponibles dans le commerce, ainsi que des candidats dans le pipeline de découverte de médicaments de Merck.
Pour les composés qui n'ont pas besoin d'étiquettes radioactives, le même processus en une étape peut échanger du deutérium, une version de l'hydrogène avec un seul neutron supplémentaire. Ces "étiquettes stables" (au deutérium) et "radio-étiquettes" (au tritium) ont d'innombrables applications, dans le milieu universitaire ainsi que la découverte de médicaments.
La simplicité de cette nouvelle approche a une autre implication, dit Jennifer Lafontaine, le directeur principal de la synthèse et de la chimie analytique de Pfizer à La Jolla, Californie, qui n'a pas participé à la recherche.
Parce que le processus précédent était si gourmand en ressources, les molécules marquées au deutérium ou au tritium n'étaient souvent créées que pour des produits chimiques « assez avancés dans le processus de découverte de médicaments, ", a-t-elle déclaré. " Cette méthodologie pourrait donc ouvrir la porte à une utilisation plus précoce et élargie du marquage isotopique dans la découverte de médicaments, améliorer considérablement notre capacité à étudier les candidats-médicaments à un niveau plus profond, et à travers une gamme d'applications."
Cette nouvelle méthode tire parti du domaine émergent de la photocatalyse lancé à Princeton et l'a appliqué à un autre nouveau domaine, dit MacMillan. Il a aussi une valeur financière évidente, mais il l'a écarté.
"Personne ne brevete rien de tout cela, parce que nous voulons qu'il soit accessible à tous, " a déclaré MacMillan.
Cette technologie a été développée en collaboration avec Merck au Merck Catalysis Center de Princeton, où l'étudiant diplômé de Princeton Yong Yao Loh et le chercheur postdoctoral Kazunori Nagao ont mené des recherches à l'aide de la matière radioactive, dit Ian Davies, un co-auteur sur le Science document qui était le chercheur principal du laboratoire partenaire de Merck pendant la réalisation de la recherche.
« C'est un excellent exemple de collaboration entre Princeton et l'industrie qui profite à la science et à l'ensemble de la société, ", a déclaré Davies.