Des chercheurs de l'Université Rice ont introduit des blocs de construction d'acides aminés non canoniques dans les protéines des cellules vivantes, pionnier d'un outil puissant pour étudier et manipuler la structure et la fonction des protéines. L'organisme non naturel résultant, une souche de bactérie Escherichia coli, est capable de surveiller de faibles niveaux de stress oxydatif. Crédit :Xiao Lab/Université du riz
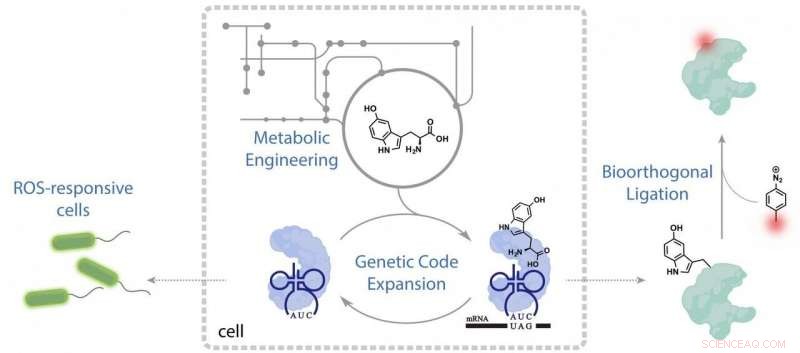
Le chimiste de l'Université Rice Han Xiao et son équipe ont réussi à étendre le code génétique de la bactérie Escherichia coli pour produire un bloc de construction synthétique, un "acide aminé non canonique". Le résultat est un indicateur vivant du stress oxydatif.
L'oeuvre, ils disent, est une étape vers des technologies qui permettront la génération de nouvelles protéines et d'organismes dotés d'une variété de fonctions utiles.
Leur étude paraît dans la revue Cell Press Chimie .
Les acides aminés sont les éléments constitutifs de l'ADN. En général, les organismes n'en ont besoin que de 20 pour programmer l'ensemble des protéines nécessaires à la vie. Mais Xiao, avec l'aide d'une subvention de 1,8 million de dollars du National Institutes of Health, a entrepris de voir comment un 21e acide aminé permettrait la conception d'"organismes non naturels" qui servent à des fins spécifiques.
C'est exactement ce que fait la nouvelle étude en créant des bactéries pour produire l'acide aminé supplémentaire, appelé 5-hydroxyl-tryptophane (5HTP), qui apparaît naturellement chez l'homme comme précurseur du neurotransmetteur sérotonine, mais pas dans E. coli. La nouvelle production de 5HTP incite les bactéries à produire une protéine qui devient fluorescente lorsque l'organisme est soumis à un stress métabolique.
« Le processus nécessite beaucoup de techniques interdisciplinaires, " dit Xiao. " Dans cette étude, nous avons combiné la chimie de synthèse, biologie synthétique et ingénierie métabolique pour créer une souche qui synthétise et code un 21e acide aminé non canonique, et l'utilise ensuite pour produire la protéine désirée."
Xiao a déclaré que la programmation des bactéries non naturelles autonomes était un processus en trois étapes :les chercheurs dirigés par l'étudiant diplômé Yuda Chen ont créé une machinerie traductionnelle bioorthogonale pour l'acide aminé, 5HTP. Seconde, ils ont trouvé et ciblé un codon vierge - une séquence d'ADN ou d'ARN qui ne produit pas de protéine - et l'ont modifié génétiquement pour coder le 5HTP. Troisième, en greffant des amas d'enzymes d'autres espèces dans E. coli, ils ont donné aux bactéries la capacité de produire du 5HTP.
"Ces protéines contenant du 5HTP, isolé des bactéries programmées, peut être en outre marqué avec des médicaments ou d'autres molécules, " dit Xiao. " Tiens, nous montrons que la souche elle-même peut servir d'indicateur vivant pour les espèces réactives de l'oxygène, et la limite de détection est vraiment basse."
Alors que les chercheurs ont signalé la création de plus de 200 acides aminés non canoniques à ce jour, la plupart d'entre eux ne peuvent pas être synthétisés par leurs organismes hôtes. "C'est un domaine en cours depuis des décennies, mais auparavant les gens se concentraient sur la partie chimique, " a déclaré Xiao. "Notre vision est de concevoir des cellules entières avec le 21e acide aminé qui nous permettra d'étudier les problèmes biologiques ou médicaux dans les organismes vivants, plutôt que de simplement traiter avec des cellules en laboratoire.
« Déplacer cette technologie vers l'espèce hôte élimine le besoin d'injecter des blocs de construction artificiels dans un organisme, parce qu'ils peuvent le synthétiser et l'utiliser eux-mêmes, " a-t-il dit. " Cela nous permet d'étudier les acides aminés non canoniques à un niveau supérieur, niveau de l'organisme entier."
Finalement, les chercheurs espèrent que des blocs de construction personnalisés permettront des cellules ciblées, comme ceux des tumeurs, fabriquer leurs propres médicaments thérapeutiques. "C'est une orientation future importante pour mon laboratoire, " dit Xiao. " Nous voulons que les cellules détectent les maladies, faire de meilleurs médicaments et les libérer en temps réel. Nous ne pensons pas que ce soit trop loin."
Les co-auteurs de l'article sont les boursiers postdoctoraux Rice Juan Tang, Lushun Wang et Zeru Tian, l'étudiant de premier cycle Adam Cardenas et le chercheur invité Xinlei Fang, et Abhishek Chatterjee, professeur adjoint de chimie au Boston College. Xiao est le Norman Hackerman-Welch Young Investigator et professeur adjoint de chimie.