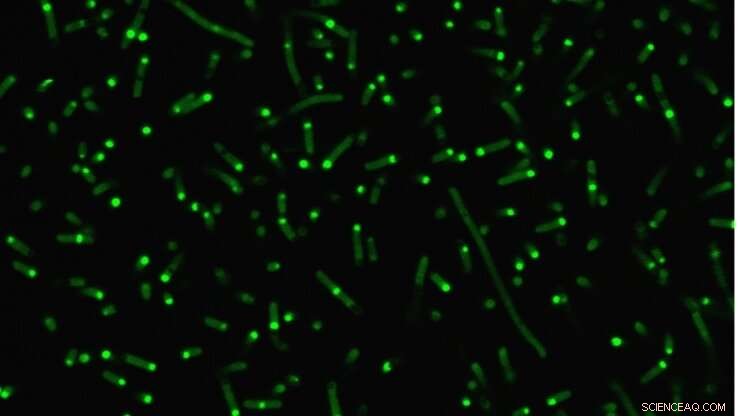
Les protéines intrinsèquement désordonnées (vert fluorescent) s'agglutinent dans les cellules pour former des organites artificiels. Crédit :Université Duke
Les ingénieurs biomédicaux de l'Université Duke ont démontré une méthode pour contrôler la séparation de phase d'une classe émergente de protéines pour créer des organites artificiels sans membrane dans les cellules humaines. L'avance, similaire à contrôler la façon dont le vinaigre forme des gouttelettes dans l'huile, crée des opportunités pour l'ingénierie des structures synthétiques pour moduler les fonctions cellulaires existantes ou créer des comportements entièrement nouveaux dans les cellules.
Les résultats paraissent en ligne le 3 août dans la revue Chimie de la nature .
Les protéines fonctionnent en se repliant dans des formes 3D spécifiques qui interagissent avec différentes structures biomoléculaires. Les chercheurs pensaient auparavant que les protéines avaient besoin de ces formes fixes pour fonctionner. Mais au cours des deux dernières décennies, une grande nouvelle classe de protéines intrinsèquement désordonnées (IDP) a été découverte qui ont de grandes régions qui sont « disquettes », c'est-à-dire ils ne se plient pas en une forme 3D définie. Il est maintenant compris que ces régions jouent un rôle important, rôle auparavant non reconnu dans le contrôle de diverses fonctions cellulaires.
Les IDP sont également utiles pour les applications biomédicales car ils peuvent subir des transitions de phase - passer d'un liquide à un gel, par exemple, ou d'un état soluble à un état insoluble, et vice-versa—en réponse à des déclencheurs environnementaux, comme les changements de température. Ces caractéristiques dictent également leur comportement de phase dans les environnements cellulaires et sont contrôlées en ajustant les caractéristiques des IDP telles que leur poids moléculaire ou la séquence dans laquelle les acides aminés sont liés entre eux.
"Bien qu'il existe de nombreux IDP naturels qui montrent un comportement de phase dans les cellules, ils viennent dans beaucoup de saveurs différentes, et il a été difficile de discerner les règles qui régissent ce comportement, " dit Ashutosh Chilkoti, le professeur distingué Alan L. Kaganov de génie biomédical à Duke. "Cet article fournit des principes d'ingénierie très simples pour programmer ce comportement dans une cellule."
« D'autres sur le terrain ont adopté une approche descendante où ils modifieront un IDP naturel et verront comment son comportement change au sein d'une cellule, " a déclaré Michael Dzuricky, un chercheur travaillant dans le laboratoire Chilkoti et premier auteur de l'étude. "Nous adoptons l'approche opposée et construisons nos propres IDP artificiels à partir de principes thermodynamiques simples. Cela nous permet, ainsi qu'à d'autres, d'ajuster avec précision une seule propriété - la forme du diagramme de phase des IDP - pour mieux comprendre comment ce paramètre affecte le comportement biologique "
Dans le nouveau journal, les chercheurs commencent par chercher dans la nature des exemples de PDI qui se rassemblent pour former des "condensats biomoléculaires" dans les cellules. Ces structures faiblement liées permettent aux cellules de créer des compartiments sans également construire une membrane pour l'encapsuler. En utilisant un tel IDP de la mouche commune des fruits comme base, les chercheurs s'appuient sur leur longue histoire de travail avec les personnes déplacées pour concevoir une version artificielle moléculairement plus simple qui conserve le même comportement.
Cette version plus simple a permis aux chercheurs d'apporter des modifications précises au poids moléculaire de l'IDP et aux acides aminés des IDP. Les chercheurs montrent que, selon la façon dont ces deux variables sont ajustées, les IDPs se réunissent pour former ces compartiments à différentes températures dans un tube à essai. Et en essayant constamment divers réglages et températures, les chercheurs ont acquis une solide compréhension des paramètres de conception les plus importants pour contrôler le comportement de l'IDP.
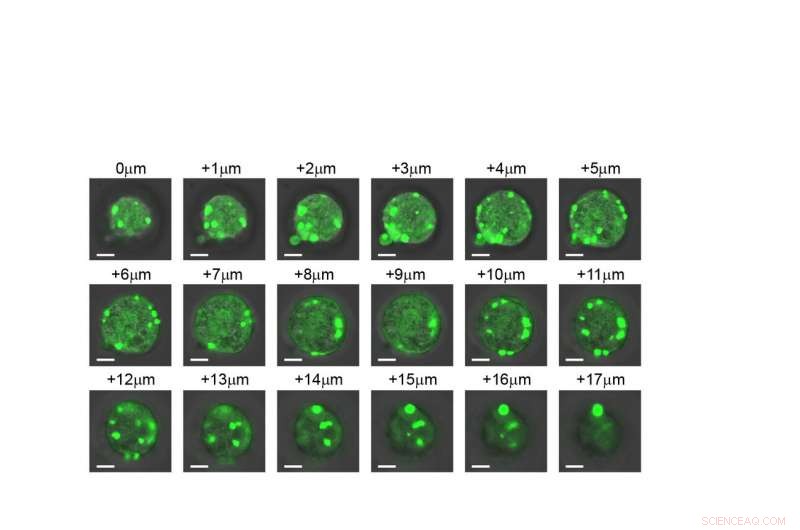
Une vue tranche par tranche d'une cellule montrant que les organites artificiels se forment dans toute la structure. Crédit :Université Duke
Une éprouvette, cependant, n'est pas la même chose qu'une cellule vivante, les chercheurs sont donc allés encore plus loin pour démontrer comment leurs IDP modifiés se comportent au sein d'E. coli. Comme prédit, leurs IDP artificiels se sont regroupés pour former une minuscule gouttelette dans le cytoplasme de la cellule. Et parce que le comportement de l'IDP était maintenant si bien compris, les chercheurs ont montré qu'ils pouvaient contrôler de manière prévisible la façon dont ils fusionnaient en utilisant les principes de leur tube à essai comme guide.
« Nous avons pu modifier les températures dans les cellules pour développer une description complète de leur comportement de phase, qui reflétait nos prédictions de tubes à essai, " a déclaré Dzuricky. " À ce stade, nous avons pu concevoir différents systèmes IDP artificiels où les gouttelettes qui se forment ont des propriétés matérielles différentes."
En d'autres termes, parce que les chercheurs ont compris comment manipuler la taille et la composition des PDI pour répondre à la température, ils pourraient programmer les IDPs pour former des gouttelettes ou des compartiments de densités variables à l'intérieur des cellules. Pour montrer comment cette capacité pourrait être utile aux ingénieurs biomédicaux, les chercheurs ont ensuite utilisé leurs nouvelles connaissances, comme le fait souvent la nature, pour créer un organite qui remplit une fonction spécifique dans une cellule.
Les chercheurs ont montré qu'ils pouvaient utiliser les IDP pour encapsuler une enzyme afin de contrôler son niveau d'activité. En faisant varier le poids moléculaire des IDP, les IDPs maintiennent l'enzyme augmentée ou diminuée, ce qui à son tour a affecté combien il pourrait interagir avec le reste de la cellule.
Pour démontrer cette capacité, les chercheurs ont choisi une enzyme utilisée par E. coli pour convertir le lactose en sucres utilisables. Cependant, dans ce cas, les chercheurs ont suivi l'activité de cette enzyme avec un rapporteur fluorescent en temps réel pour déterminer comment l'organite IDP modifiée affectait l'activité enzymatique.
À l'avenir, les chercheurs pensent qu'ils pourraient utiliser leurs nouveaux organites IDP pour contrôler les niveaux d'activité des biomolécules importantes pour les états pathologiques. Ou pour apprendre comment les PDI naturels remplissent des rôles cellulaires similaires et comprendre comment et pourquoi ils fonctionnent parfois mal.
"C'est la première fois que quelqu'un est capable de définir avec précision comment la séquence protéique contrôle le comportement de séparation de phases à l'intérieur des cellules, " a déclaré Dzuricky. "Nous avons utilisé un système artificiel, mais nous pensons que les mêmes règles s'appliquent aux déplacés internes naturels et nous sommes ravis de commencer à tester cette théorie."
"Nous pouvons aussi maintenant commencer à programmer ce type de comportement de phase avec n'importe quelle protéine dans une cellule en les fusionnant à ces IDP artificiels, " a déclaré Chilkoti. "Nous espérons que ces IDP artificiels fourniront un nouvel outil pour la biologie synthétique pour contrôler le comportement des cellules."