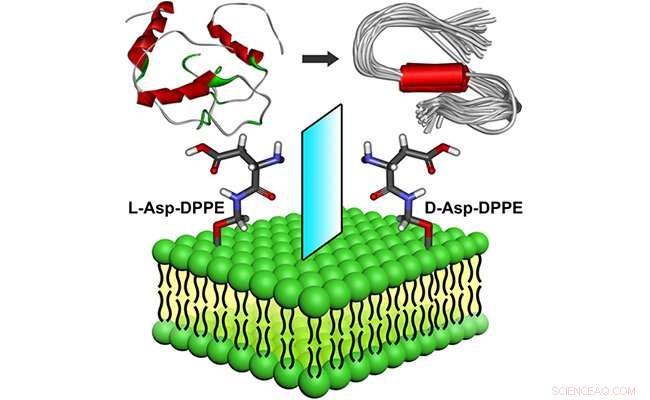
La chiralité moléculaire a induit la formation d'amyloïde sur les surfaces phospholipidiques. Crédit :WANG Xue
La maladie d'Alzheimer (MA) est l'un des plus grands défis mondiaux de santé publique. Cependant, la pathogenèse de la MA est encore incertaine.
Un certain nombre d'études ont montré que les membranes cellulaires jouent un rôle crucial dans la progression de la MA, en particulier l'accumulation d'amyloïde-β (Aβ). Il est donc essentiel d'étudier l'effet des membranes biologiques sur la formation d'amyloïde.
Récemment, des groupes de recherche dirigés par le professeur Qing Guangyan et le professeur Li Guohui du Dalian Institute of Chemical Physics de l'Académie chinoise des sciences ont conçu et préparé une paire de phospholipides chiraux modifiés en acides aminés, montrant une influence remarquable de la chiralité moléculaire des liposomes chiraux sur la formation d'amyloïde.
Les chercheurs ont découvert que les liposomes L auto-assemblés inhibaient légèrement le processus de nucléation Aβ(1-40) mais ne pouvaient pas affecter le processus d'élongation des oligomères. Par comparaison, les D-liposomes ont fortement inhibé à la fois les processus de nucléation et d'élongation de Aβ(1-40).
Les liposomes chiraux avaient non seulement une bonne biocompatibilité, mais pouvaient également sauver la cytotoxicité induite par l'agrégation Aβ(1-40) avec une discrimination chirale significative, dans laquelle la viabilité cellulaire était plus élevée en présence de D-liposomes.
Pendant ce temps, les scientifiques ont révélé le site de liaison, manières de liaison et force motrice entre Aβ(1-40) et les surfaces chirales de phospholipides grâce à des simulations détaillées de dynamique moléculaire.
Ces découvertes ont élargi la recherche des surfaces chirales artificielles à de vraies surfaces chirales phospholipidiques, fournissant un aperçu plus profond et réel pour comprendre le processus crucial de l'amylose du point de vue de la biointerface chirale.
Les liposomes ont une biocompatibilité convaincante, et la convergence des liposomes avec des acides aminés D non naturels en tant qu'inhibiteurs de l'amyloïde sont prometteuses dans la prévention et le traitement précoces de la MA, qui indique une direction claire pour le développement d'inhibiteurs à base de liposomes.
L'étude a été publiée dans Sciences chimiques le 25 juin.