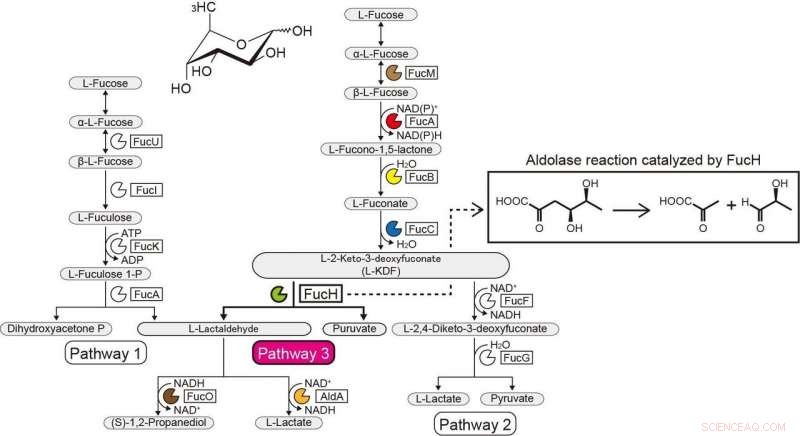
Voies métaboliques du L-Fucose. Crédit :Université d'Ehime
Le contexte génétique dans les génomes bactériens et le criblage de substrats potentiels peuvent aider à identifier les fonctions biochimiques des enzymes bactériennes. Le Gram-négatif, La bactérie strictement anaérobie Veillonella ratti possède un groupe de gènes qui semble être lié au métabolisme du L-fucose et contient une protéine putative dihydrodipolinate synthase DHDPS/NAL (FucH). Ici, le criblage d'une bibliothèque d'acides 2-céto-3-désoxysucre avec cette protéine et la caractérisation biochimique des gènes voisins ont révélé que ce groupe de gènes code pour des enzymes dans une voie de L-fucose non phosphorylée "Route I" jusqu'alors inconnue.
Des études antérieures sur d'autres aldolases de la superfamille des protéines DHDPS/NAL n'utilisaient qu'un nombre limité de composés, et l'approche rapportée ici a permis d'élucider les spécificités de substrat et les sélectivités stéréochimiques de ces aldolases et de les comparer avec celles de FucH. Selon la réaction de clivage aldol, les aldolases étaient spécifiques des groupes stéréospécifiques (R) et (S) en position C4 de l'acide 2-céto-3-désoxysucre, mais n'avait pas de spécificité structurelle ou de préférence pour les groupes méthyle aux positions C5 et C6, respectivement.
Cette catégorisation correspondait à la sélectivité (Re)- ou (Si)-faciale de l'énamine pyruvate sur le (glycer)aldéhyde carbonyle dans la réaction d'aldol-condensation. Ces propriétés sont généralement déterminées par le fait qu'un résidu de sérine ou de thréonine est positionné à la position équivalente à proximité du ou des sites actifs, et la mutagenèse dirigée a sensiblement modifié la préférence C4-OH et la formation sélective d'un diastéréoisomère. Nous proposons que la spécificité de substrat des aldolases d'acide 2-céto-3-désoxysucre a été acquise de manière convergente au cours de l'évolution et rapportons la découverte d'une autre aldolase L-2-céto-3-désoxyfuconate impliquée dans la même voie de L-fucose non phosphorylée chez Campylobacter jejuni .
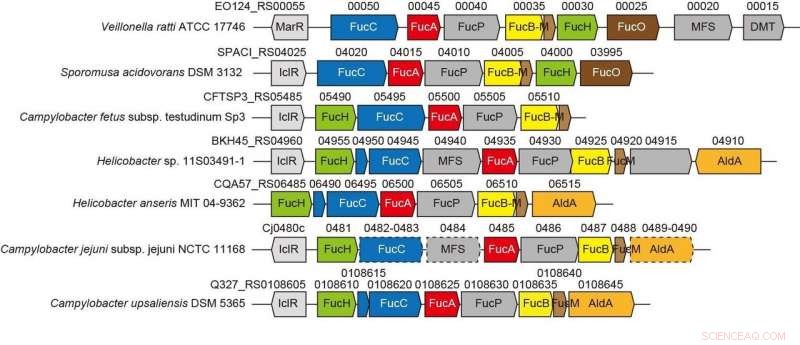
Groupes de gènes liés à la nouvelle voie non phosphorylative du L-fucose à partir de bactéries anaérobies et pathogènes. Crédit :Université Ehime