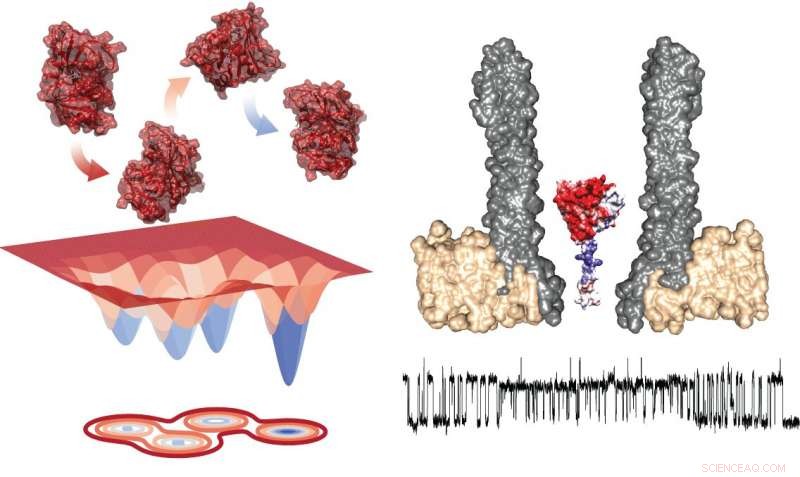
Diagramme énergétique des quatre conformères (à gauche) et du montage expérimental montrant le nanopore avec l'enzyme piégée en coupe transversale (à droite). Sous, il existe une trace typique montrant les mesures lors des échanges au sein des rotamères. Crédit :Giovanni Maglia, Université de Groningue
Des scientifiques de l'Université de Groningue ont observé les caractéristiques d'une seule enzyme à l'intérieur d'un nanopore. Ils ont appris que l'enzyme peut exister dans quatre états repliés différents, ou conformateurs, qui jouent un rôle actif dans le mécanisme de réaction. Ces résultats auront des conséquences pour l'ingénierie enzymatique et le développement d'inhibiteurs. L'étude a été publiée dans Chimie de la nature le 6 avril.
Les enzymes sont des protéines repliées qui ont une structure tridimensionnelle spécifique qui crée un site actif qui peut se lier à un substrat et catalyser une réaction spécifique. Dans les années récentes, il est devenu clair que les enzymes ne sont pas des structures rigides, mais que les protéines repliées existent comme un ensemble de conformations en équilibre autour d'un état fondamental énergétiquement stable.
Soufflerie
L'étude de la transition entre les états nécessite l'observation d'enzymes uniques pendant une période de temps prolongée, ce qui est difficile. Giovanni Maglia, professeur agrégé de biologie chimique à l'Université de Groningue, a développé des nanopores en forme d'entonnoir capables de piéger les protéines. En mesurant le courant ionique à travers un tel nanopore intégré dans une membrane lipidique artificielle, Maglia a pu observer des changements de conformation des enzymes. "Vous pouvez comparer cela avec l'étude d'une voiture dans une soufflerie, " explique-t-il. " L'ouverture d'une fenêtre ou d'une porte va modifier le flux d'air. D'une manière similaire, un changement dans la structure de repliement de l'enzyme modifie le courant ionique à travers le pore."
Maglia a utilisé son système nanopore pour étudier l'enzyme dihydrofolate réductase (DHFR), qui transforme le dihydrofolate en tétrahydrofolate. "Nous avons choisi cette enzyme car elle est étudiée comme système modèle pour la dynamique enzymatique depuis plus de 30 ans, en utilisant toutes les techniques disponibles. En outre, inhibiteurs de cette enzyme, comme le méthotrexate, sont utilisés comme médicaments anticancéreux.
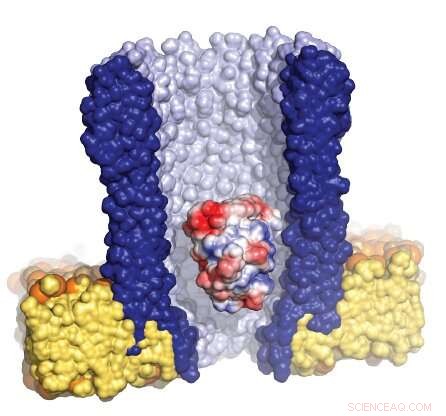
Illustration du nanopore en forme d'entonnoir (bleu) entouré de la membrane artificielle (jaune), avec une seule enzyme (rouge/blanc/bleu) piégée à l'intérieur du pore. Crédit :Giovanni Maglia, Université de Groningue
Libération efficace
Les mesures de DHFR ont révélé la présence de quatre conformères avec différentes affinités pour les substrats. Maglia dit, "La commutation entre ces quatre états était très lente. Cela signifie que vous ne pouvez les voir que dans ce genre d'études d'enzyme unique de longue durée."
Ajout de l'inhibiteur de réaction méthotrexate, qui se lie à l'enzyme, a provoqué une transition très rapide entre les états et a modifié l'affinité des enzymes. "Notre conclusion est que les réactions de l'enzyme avec différents composés fournissent l'énergie gratuite pour les changements de conformation, " dit Maglia.
Par ailleurs, le changement de conformation a également modifié l'affinité des enzymes. C'est logique, car l'enzyme doit se lier à deux substrats et, après avoir terminé la réaction, doit libérer les deux. « Le substrat et le produit sont des molécules très proches, l'enzyme doit donc changer son affinité pour une libération efficace."
Deux états
Sur la base de ces études, Maglia peut voir l'enzyme basculer entre deux états :après avoir lié le substrat, NADPH conduit la réaction, ce qui modifie alors la conformation de l'enzyme et donc son affinité. Ensuite, la liaison d'un nouveau substrat le ramène au premier état. « Cela explique deux des quatre conformères que nous avons observés ; nous ne pouvons pas encore comprendre les deux autres, " dit Maglia. Il est impossible de dériver des informations structurelles à partir des mesures.
Néanmoins, l'étude montre la puissance de la technologie des nanopores pour déterminer les changements structurels des enzymes. "Nous savons également maintenant que cette enzyme a quatre états fondamentaux différents et doit basculer entre eux pour fonctionner." Cela ajoute un défi à la conception de l'enzyme :non seulement cela devrait-il produire un centre réactif, mais il doit aussi permettre les changements conformationnels nécessaires. Maglia : « Cela peut expliquer pourquoi les enzymes conçues artificiellement ne fonctionnent souvent pas aussi efficacement que les enzymes naturelles. » Finalement, l'étude permettra également aux scientifiques d'identifier de nouveaux médicaments inhibiteurs qui se lient plus étroitement à la DHFR que le méthotrexate.