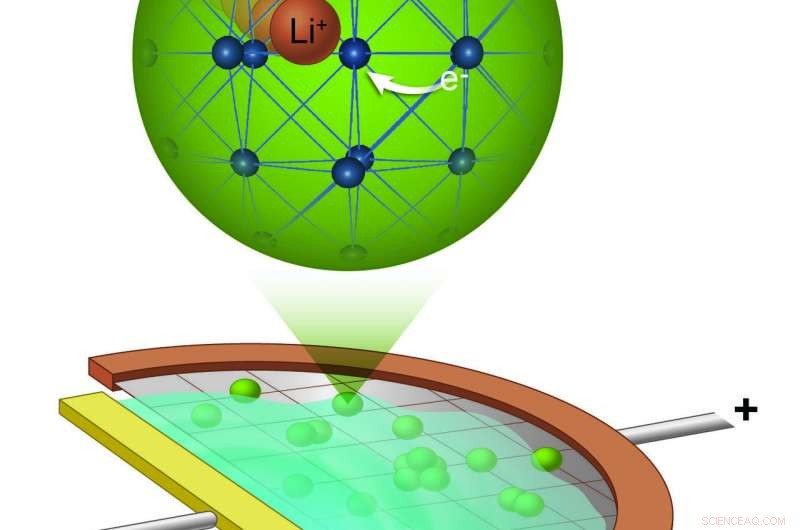
Un schéma de la mini cellule électrochimique que les scientifiques ont construite pour chasser les ions lithium (orange) se déplaçant dans le réseau de LTO (bleu). Crédit :Laboratoire national de Brookhaven
Une équipe de scientifiques dirigée par le Brookhaven National Laboratory du département américain de l'Énergie (DOE) et le Lawrence Berkeley National Laboratory a capturé en temps réel comment les ions lithium se déplacent dans le titanate de lithium (LTO), un matériau d'électrode de batterie à charge rapide en lithium, titane, et de l'oxygène. Ils ont découvert que les arrangements déformés du lithium et des atomes environnants dans les "intermédiaires" LTO (structures de LTO avec une concentration en lithium entre ses états initial et final) fournissent une "voie express" pour le transport des ions lithium. Leur découverte, rapporté dans le numéro du 28 février de Science , pourrait fournir des informations sur la conception de matériaux de batterie améliorés pour la recharge rapide des véhicules électriques et des appareils électroniques portables grand public tels que les téléphones portables et les ordinateurs portables.
"Considérez qu'il ne faut que quelques minutes pour faire le plein d'essence d'une voiture mais quelques heures pour recharger la batterie d'un véhicule électrique, " a déclaré l'auteur co-correspondant Feng Wang, un scientifique des matériaux au département des sciences interdisciplinaires du Brookhaven Lab. « Découvrir comment accélérer le déplacement des ions lithium dans les matériaux d'électrode est un gros problème, car cela peut nous aider à construire de meilleures batteries avec un temps de charge considérablement réduit."
Les batteries lithium-ion fonctionnent en mélangeant les ions lithium entre une électrode positive et négative (cathode et anode) à travers un milieu chimique appelé électrolyte. Le graphite est couramment utilisé comme anode dans les batteries lithium-ion de pointe, mais pour les applications à charge rapide, LTO est une alternative intéressante. LTO peut accueillir des ions lithium rapidement, sans souffrir de placage de lithium (le dépôt de lithium sur la surface de l'électrode au lieu de l'intérieur).
Comme LTO s'adapte au lithium, il se transforme à partir de sa phase d'origine (Li
Dans cette étude, les scientifiques ont pu suivre en temps réel la migration des ions lithium dans les nanoparticules LTO en concevant une cellule électrochimique fonctionnant à l'intérieur d'un microscope électronique à transmission (MET). Cette cellule électrochimique a permis à l'équipe de réaliser une spectroscopie électronique de perte d'énergie (EELS) pendant la charge et la décharge de la batterie. Dans EELS, le changement d'énergie des électrons après leur interaction avec un échantillon est mesuré pour révéler des informations sur les états chimiques locaux de l'échantillon. En plus d'être très sensible aux ions lithium, anguilles, lorsqu'il est effectué à l'intérieur d'un MET, fournit la haute résolution dans l'espace et dans le temps nécessaire pour capturer le transport des ions dans les nanoparticules.
« L'équipe a relevé un défi à plusieurs niveaux en développant la cellule électrochimiquement fonctionnelle :faire en sorte que le cycle cellulaire ressemble à une batterie ordinaire tout en s'assurant qu'il était suffisamment petit pour tenir dans l'espace d'échantillon de la taille d'un millimètre de la colonne TEM. '', a déclaré le co-auteur et scientifique principal Yimei Zhu, qui dirige le groupe Microscopie électronique et nanostructure de la division Physique de la matière condensée et science des matériaux (CMPMS) de Brookhaven. "Pour mesurer les signaux EELS du lithium, un échantillon très fin est nécessaire, au-delà de ce qui est normalement requis pour la transparence des électrons de sondage dans les MET."
Les spectres EELS résultants contenaient des informations sur l'occupation et l'environnement local du lithium à divers états de LTO à mesure que la charge et la décharge progressaient. Pour déchiffrer les informations, des scientifiques du groupe de recherche sur la conception informatique et expérimentale des matériaux émergents (CEDER) à Berkeley et le Center for Functional Nanomaterials (CFN) à Brookhaven ont simulé les spectres. Sur la base de ces simulations, ils ont déterminé les arrangements des atomes parmi des milliers de possibilités. Pour déterminer l'impact de la structure locale sur le transport des ions, le groupe CEDER a calculé les barrières énergétiques de la migration lithium-ion en LTO, en utilisant des méthodes basées sur la mécanique quantique.
"La modélisation informatique était très importante pour comprendre comment le lithium peut se déplacer si rapidement à travers ce matériau, " a déclaré Gerbrand Ceder, auteur co-correspondant et chef du groupe CEDER, Professeur chancelier au Département de science et d'ingénierie des matériaux de l'UC Berkeley et chercheur principal à la Division des sciences des matériaux du Berkeley Lab. "Comme le matériau absorbe du lithium, l'arrangement atomique devient très complexe et difficile à conceptualiser avec des idées de transport simples. Les calculs ont pu confirmer que l'entassement des ions lithium les rend très mobiles."
"Un aspect important de ce travail était la combinaison de l'expérience et de la simulation, car les simulations peuvent nous aider à interpréter les données expérimentales et à développer une compréhension mécaniste, " a déclaré le co-auteur Deyu Lu, un physicien dans le groupe de théorie et de calcul du CFN. "L'expertise en spectroscopie informatique que nous avons développée au CFN au fil des ans joue un rôle important dans ce projet utilisateur collaboratif pour identifier les empreintes spectrales clés dans EELS et démêler leur origine physique dans les structures atomiques et leurs propriétés électroniques."
L'analyse de l'équipe a révélé que LTO a des configurations intermédiaires métastables dans lesquelles les atomes ne sont pas localement dans leur disposition habituelle. Ces distorsions locales « polyédriques » abaissent les barrières énergétiques, fournissant une voie à travers laquelle les ions lithium peuvent voyager rapidement.
"Contrairement à l'essence qui s'écoule librement dans le réservoir d'essence de votre voiture, qui est essentiellement un conteneur vide, le lithium doit "se battre" pour se frayer un chemin dans le LTO, qui n'est pas une structure complètement ouverte, " a expliqué Wang. " Pour obtenir du lithium, LTO se transforme d'une structure à une autre. Typiquement, une telle transformation en deux phases prend du temps, limitant la capacité de charge rapide. Cependant, dans ce cas, le lithium est logé plus rapidement que prévu car les distorsions locales dans la structure atomique du LTO créent un espace plus ouvert à travers lequel le lithium peut facilement passer. Ces voies hautement conductrices se produisent aux frontières abondantes existant entre les deux phases. »
Prochain, les scientifiques exploreront les limites du LTO, telles que la génération de chaleur et la perte de capacité associée au cyclage à des vitesses élevées, pour des applications réelles. En examinant le comportement du LTO après avoir absorbé et libéré à plusieurs reprises du lithium à différentes vitesses de cyclage, ils espèrent trouver des remèdes à ces problèmes. Ces connaissances éclaireront le développement de matériaux d'électrodes pratiquement viables pour les batteries à charge rapide.
"Les efforts trans-institutionnels combinant la spectroscopie in situ, électrochimie, calcul, et la théorie dans ce travail a établi un modèle pour la conduite de recherches futures, " dit Zhu.
« Nous sommes impatients d'examiner de plus près les comportements de transport dans les électrodes à charge rapide en adaptant notre nouvelle cellule électrochimique aux puissants microscopes électroniques et à rayons X du CFN de Brookhaven et de la National Synchrotron Light Source II (NSLS-II), " a déclaré Wang. " En tirant parti de ces outils de pointe, nous pourrons acquérir une vue complète du transport du lithium dans les structures locales et en vrac des échantillons pendant le cycle en temps réel et dans des conditions de réaction réelles. »