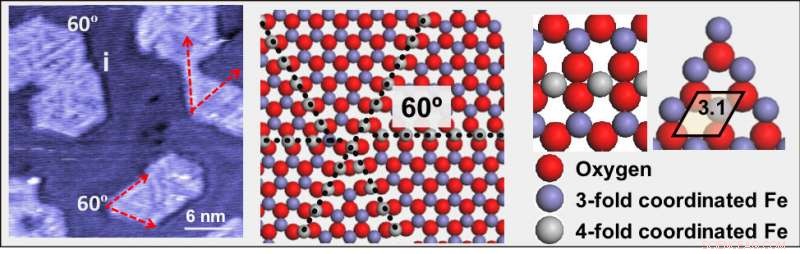
(À gauche) Une image au microscope à effet tunnel à pression ambiante d'oxyde de fer (FeO) sur une surface d'or. (Au milieu) Une illustration montrant des lignes de dislocation constituées d'atomes de fer (gris), entouré de quatre atomes d'oxygène (rouge). (À droite) Un modèle agrandi montrant des atomes de fer coordonnés par trois (violet) et quatre (gris) atomes d'oxygène (rouge). Crédit :Laboratoire national de Brookhaven
Catalyseurs, ou des substances qui accélèrent les réactions chimiques, ont diverses applications industrielles. Un catalyseur largement utilisé dans les convertisseurs catalytiques est le palladium, qui aide à transformer le monoxyde de carbone et les hydrocarbures toxiques des gaz d'échappement des véhicules en dioxyde de carbone et en eau par oxydation. Mais comme d'autres métaux précieux comme le platine, le palladium est rare. En raison de son offre limitée, le palladium est une denrée chère.
Le remplacement des catalyseurs de métaux précieux par ceux à base de métaux plus abondants comme le fer réduirait considérablement leur coût. Cependant, catalyseurs de fer, tout en étant très efficace, ont tendance à se désactiver rapidement. Par exemple, les catalyseurs à base d'oxyde de fer s'empoisonnent lorsque leurs surfaces sont recouvertes d'espèces carbonées formées lors de réactions avec des molécules carbonées, comme lorsque le monoxyde de carbone se dissocie en carbone et en oxygène. Le carbone déposé à la surface du catalyseur bloque les sites actifs et empêche d'autres réactions d'avoir lieu, ainsi "empoisonner" et finalement désactiver le catalyseur.
"Une forme d'oxyde de fer, FeO, est un matériau très peu coûteux qui est actif pour l'oxydation, mais trop actif pour son propre bien, " dit Dario Stacchiola, chef de l'Interface Science and Catalysis Group au Center for Functional Nanomaterials (CFN) - une installation utilisateur du Bureau des sciences du département de l'Énergie des États-Unis (DOE) au Brookhaven National Laboratory - et professeur adjoint au département de chimie de l'Université Stony Brook. "Créer des structures avec du fer suffisamment actif pour favoriser la réaction sans se désactiver pourrait ouvrir la porte à l'utilisation de ces catalyseurs dans des applications pratiques."
Stacchiola et ses collaborateurs ont trouvé une structure qui pourrait être capable de faire exactement cela. Les scientifiques ont préparé une fine couche de nanoparticules de FeO sur une surface d'or et ont découvert que les lignes de dislocation apparaissant à la surface de FeO sont très actives mais ne sont pas empoisonnées. Ces lignes de défauts sont constituées d'atomes de fer entourés de quatre atomes d'oxygène au lieu des trois normaux.
L'équipe a détecté les défauts dans les images haute résolution enregistrées par microscopie à effet tunnel à basse température (STM) à l'installation de sondes proximales CFN et à l'Université des sciences et technologies de Nanjing en Chine, où Tianchao Niu, membre de l'équipe et ancien postdoctorant du CFN, est maintenant professeur. À la STM, le courant électrique est mesuré sous forme de tunnel d'électrons entre une surface d'échantillon et une pointe métallique qui balaye la surface.
Les scientifiques ont ensuite étudié l'oxydation et la réduction de FeO dans des environnements d'oxygène gazeux et de monoxyde de carbone, respectivement. Pour surveiller la structure atomique et chimique du catalyseur, ils ont effectué des études de science des surfaces à température ambiante et à pression ambiante (AP). En particulier, ils ont utilisé un instrument AP-STM de pointe mis à la disposition des utilisateurs académiques et industriels du CFN.
"Nous voulions voir si le catalyseur serait actif dans des conditions modérées car des températures ou des pressions élevées peuvent dissocier le monoxyde de carbone en carbone, désactiver le catalyseur, " a déclaré Stacchiola. " En menant ces études à pression ambiante, nous pouvons observer comment le matériau change pendant qu'il travaille. Ce n'est qu'alors que nous pourrons comprendre les processus chimiques qui se déroulent aux niveaux atomique et moléculaire."
Lors de l'oxydation, les lignes de dislocation ont disparu et la hauteur de la couche de FeO a augmenté, suggérant que des atomes d'oxygène avaient été incorporés. Une exposition séquentielle au monoxyde de carbone a entraîné la régénération des lignes de dislocation et une réduction de la hauteur de FeO, indiquant l'élimination des atomes d'oxygène. Après avoir visualisé chacune de ces étapes de réaction via AP-STM, les scientifiques ont utilisé la spectroscopie photoélectronique aux rayons X (XPS) pour déterminer quelles espèces chimiques étaient présentes et leurs états d'oxydation respectifs (nombre d'électrons retirés ou ajoutés). Cette information chimique peut être déterminée à partir de l'énergie des électrons émis par la surface de l'échantillon après excitation par les rayons X.
"L'oxydation et la réduction de FeO est réversible, " a déclaré Stacchiola. " De l'oxygène a été ajouté et retiré sans laisser de carbone derrière. Parce que le fer dans les lignes de dislocation est coordonné à un nombre différent d'atomes d'oxygène que d'habitude, son état d'oxydation change. Ce changement favorise la dissociation de l'oxygène moléculaire, une molécule très stable, en deux atomes d'oxygène. L'accumulation d'oxygène atomique à la surface du FeO favorise à son tour l'oxydation du monoxyde de carbone."
Zhao Jiang de l'Université Xi'an Jiaotong en Chine a ensuite calculé l'énergétique de la voie de réaction. Jiang a découvert que l'oxydation du monoxyde de carbone est énergétiquement plus facile lorsque des atomes d'oxygène supplémentaires sont adsorbés sur la surface de FeO.
Aller de l'avant, Stacchiola et son groupe continueront d'explorer les métaux abondants sur terre pour la catalyse. Ashley Head, un scientifique du groupe, en collaboration avec Baran Eren du Weizmann Institute of Science en Israël, ont récemment étudié le rôle que jouent les impuretés de surface et l'oxyde de manganèse dans l'amélioration catalytique des catalyseurs au cobalt pour la conversion du monoxyde de carbone et de l'hydrogène en gaz de synthèse, qui est utilisé dans la fabrication de produits chimiques et de carburants. Cette expérience a été l'une des premières entièrement menées avec l'instrument AP-XPS à l'installation de sondes proximales du CFN.
« Les installations complémentaires de microscopie et de spectroscopie in situ ouvertes aux utilisateurs du CFN sont parfaitement adaptées à ce type d'études de chimie de surface, " dit Stacchiola.