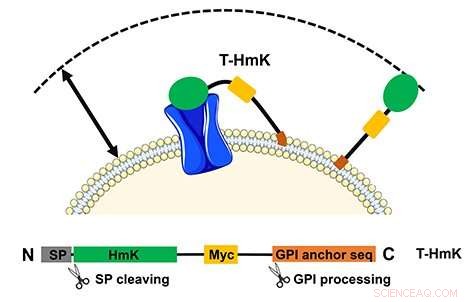
La toxine captive (T-HmK) est libérée et liée à un canal potassique (bleu) exprimé dans la membrane cellulaire. Le volume de réaction qu'un T-HmK peut visiter (flèche à deux pointes) est déterminé par les longueurs combinées du lieur peptidique flexible, l'ancre GPI, et le diamètre de la toxine HmK. Le panneau inférieur montre la conception de la construction d'expression. Crédit :École de médecine de l'UCI
Autrefois, des peptides biologiquement actifs - de petites protéines comme les neurotoxines et les hormones qui agissent sur les récepteurs cellulaires pour modifier la physiologie - ont été purifiés à partir de sources natives comme les venins, puis des panels de variantes ont été produits dans des bactéries, ou synthétisé, pour étudier la base structurelle de l'interaction avec les récepteurs. Une nouvelle technique appelée analyse zombie rend ces anciens processus obsolètes.
Les peptides sont utilisés pour la thérapie médicale et pour étudier la biologie, entre autres, mais leur coût de production en temps et en argent est de plus en plus élevé.
"Si un peptide a 30 résidus, le simple fait de changer chaque site une fois nécessite la synthèse, purification et validation de la composition repliée des 30 variants, un processus qui nécessite des mois et plusieurs milliers de dollars, " a déclaré Steven A.N. Goldstein, MARYLAND, Doctorat., vice-chancelier pour les affaires de santé à l'Université de Californie, Irvine, et professeur distingué dans les départements de pédiatrie et de physiologie et biophysique de l'UCI School of Medicine.
Publié aujourd'hui dans Avancées scientifiques , la nouvelle étude co-dirigée par Goldstein et Jordan H. Chill, Doctorat., professeur au Département de chimie de l'Université Bar-Ilan en Israël, révèle comment les chercheurs ont pu détourner la machinerie cellulaire pour simplifier la création de peptides permettant une vaste, des études rapides de structure-fonction et de mécanisme pour améliorer la spécificité et l'affinité d'action, les paramètres importants pour l'efficacité thérapeutique.
"Puisque nous détournons la machinerie cellulaire pour synthétiser et afficher les peptides à la surface cellulaire avec le récepteur, nous doublons ce balayage de zombies, " a déclaré le premier auteur Ruiming Zhao, Doctorat., chercheur au laboratoire Goldstein.
« Grâce à cette nouvelle technique, les changements de peptides sont aussi simples que la synthèse de plasmides et ne nécessitent que quelques jours de travail et quelques centimes par construction. Cela nous permet d'étudier les rôles de nombreux sites avec de nombreux changements dans un laps de temps beaucoup plus court et à un coût beaucoup plus faible."
L'étude, titré, "Les neurotoxines peptidiques captives présentent deux mécanismes de blocage dans le pore du canal K+, tout comme leurs analogues non captifs, " décrit comment les peptides codés sont liés via une voie native à l'extérieur de la cellule sur une attache flexible. Dans ce cas, le récepteur cible était également exprimé à partir d'un plasmide et pouvait être modifié. La méthode permet également l'étude d'interactions de faible affinité qu'il ne serait pas possible d'analyser autrement.
En utilisant le scan zombie, les chercheurs ont fait la découverte inattendue qu'un peptide dans les essais cliniques en tant que suppresseur immunitaire agit différemment qu'on ne le pensait, révélant que cette famille de neurotoxines a deux modes possibles d'interaction avec les canaux potassiques plutôt qu'un seul.
Chill et collègue Netanel Mendelman, Doctorat., amélioré l'impact de ces découvertes en élucidant la structure tridimensionnelle d'une neurotoxine sélectionnée à l'aide de la résonance magnétique nucléaire (RMN).
"En estimant des centaines de distances et d'angles entre les atomes du peptide, nous connaissons maintenant sa structure, offrant un contexte moléculaire à ces résultats passionnants, " a déclaré Chill. " Les deux modes de liaison semblent impliquer un " renversement " de la toxine ou un réarrangement de sa structure atomique. "
Les modes de liaison alternatifs décrits pour ces peptides sont un facteur de confusion gênant dans la conception de médicaments basés sur la structure, soulignant l'importance des conclusions de ce rapport et des futures études sur le processus de reconnaissance entre les canaux et les peptides inhibiteurs.