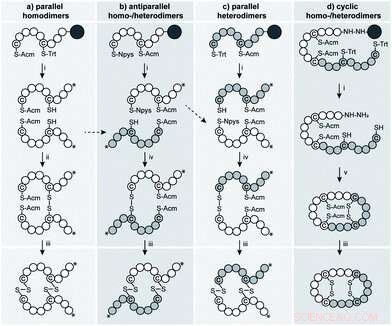
Fig. 1 Des stratégies synthétiques vers le parallèle, homo- et hétérodimères antiparallèles et cycliques à deux liaisons disulfure de VP/OT. Groupes protecteurs orthogonaux utilisés :Acm, acétamidométhyle; Npys, 3-nitro-2-pyridylsulfényle; Trt, trityle. Les acides aminés sont représentés par des cercles, les résidus de cystéine sont mis en évidence. Le cercle gris foncé représente le rink-amide- (stratégie a–c) et la 2-chlorotrityl-résine (d). *indique l'amide C-terminal. Conditions :(i) TFA : H
Les chercheurs de MedUni Vienne dirigés par Christian Gruber de l'Institut de pharmacologie, avec des collaborateurs internationaux, ont montré qu'il est possible de dimériser les neuropeptides humains ocytocine et vasopressine sans perdre une grande partie de leur efficacité. Les chercheurs se sont inspirés d'un neuropeptide acridien naturel sous la forme d'un dimère de deux molécules de type vasopressine. "En apportant des modifications structurelles à la composition et à l'orientation des dimères, nous avons réussi à modifier leur activité pharmacologique pour obtenir une inhibition ou une activation sélective du récepteur humain de la vasopressine V1a, " explique Christian Gruber de MedUni Vienne. Markus Muttenthaler de l'Université de Vienne ajoute :" La dimérisation est une stratégie souvent observée dans la nature pour optimiser la stabilité ou le mode d'action. Un bon exemple de ceci est l'insuline, qui est également un dimère de deux peptides différents."
Système de signalisation ocytocine-vasopressine vieux de 600 millions d'années
Les chercheurs ont utilisé une stratégie unique pour la découverte de nouvelles molécules d'ocytocine et de vasopressine aux propriétés pharmacologiques différentes, en exploitant les avantages des similitudes évolutives du système de signalisation ocytocine-vasopressine qui a évolué pour la première fois il y a environ 600 millions d'années et est largement répandu dans le règne animal. Ces nouvelles sondes pharmacologiques fournissent de nouvelles informations sur la fonction des récepteurs et pourraient également représenter de nouvelles pistes thérapeutiques pour plusieurs troubles.
"Notre concept est aussi innovant que fascinant :vous prenez un neuropeptide d'insecte, étudier sa structure et la reproduire avec des modifications chimiques mineures pour obtenir des pistes thérapeutiques pour les maladies humaines, " expliquent Gruber et Muttenthaler. " Il est tout aussi important de rendre ces nouvelles molécules disponibles comme outils de recherche. Ce n'est qu'en développant des molécules sélectives de sous-type de récepteur qu'il est possible d'étudier la pertinence physiologique de ces systèmes de signalisation. »
Fonctions du système de signalisation ocytocine-vasopressine étudiées
Les chercheurs visent à expliquer la pertinence pharmacologique et physiologique de ce système de signalisation. "Nous avons étudié la fonction de ce système de signalisation chez les fourmis et avons découvert que le système hormonal ocytocine-vasopressine régule la recherche de nourriture, l'activité physique et le métabolisme. » Les chercheurs supposent donc que l'ocytocine n'est pas simplement une « hormone de l'amour, " mais agit aussi potentiellement comme un coupe-faim, une application qui mérite d'être étudiée.