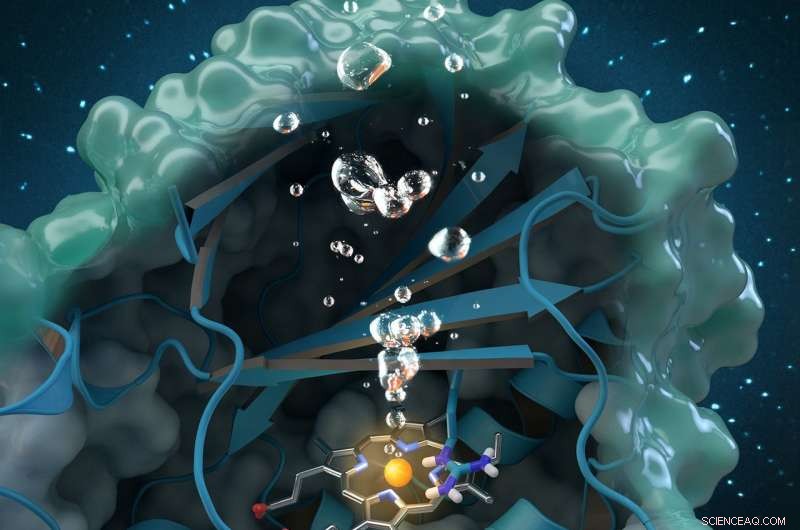
La chlorite dismutase est une enzyme génératrice d'oxygène unique qui dégrade le chlorite, un polluant industriel présent globalement dans les eaux souterraines, eau potable et sols. Les recherches menées à l'ORNL contribuent à une analyse structurale et biochimique complète de l'enzyme, ouvrant la voie à de futures applications environnementales. Crédit :Couverture du journal réimprimée avec la permission de Catalyse ACS , vol. 7, numéro 11, 3 novembre 2017.
Une nouvelle étude met en lumière une enzyme unique qui pourrait fournir un traitement respectueux de l'environnement pour les approvisionnements en eau contaminée au chlorite et améliorer la qualité de l'eau dans le monde entier.
Une équipe internationale de chercheurs dirigée par Christian Obinger de l'Université de Vienne a utilisé l'analyse neutronique au Oak Ridge National Laboratory, cristallographie aux rayons X et autres techniques pour étudier l'enzyme chlorite dismutase. Cette protéine naturelle peut décomposer le chlorite, un polluant industriel présent dans les eaux souterraines, eau potable et sols, en sous-produits inoffensifs, mais son processus catalytique n'est pas bien compris. Comprendre comment l'enzyme bactérienne convertit le chlorite en chlorure et en oxygène pourrait ouvrir des possibilités d'applications futures en bioremédiation et en biotechnologie.
Les résultats, Publié dans Catalyse ACS , contribuent également à la recherche fondamentale sur la capacité de l'enzyme à produire de l'oxygène. La génération d'oxygène est incroyablement rare dans la nature, une fois pensé possible que par la photosynthèse, ainsi, l'activité enzymatique de la chlorite dismutase a suscité l'intérêt de la communauté scientifique au-delà de ses applications environnementales pour l'eau propre.
Le fonctionnement exact de la chlorite dismutase au niveau moléculaire pour décomposer la chlorite a été débattu depuis la découverte de l'enzyme en 1996. La complexité de la structure moléculaire de l'enzyme et la difficulté d'étudier les protéines avec des méthodes expérimentales présentent des défis inhérents pour les chercheurs.
Comme la plupart des enzymes, la chlorite dismutase est une protéine qui catalyse une réaction hautement spécifique. Le processus est souvent dépendant de l'environnement, ce qui signifie qu'il fonctionne mieux dans des paramètres spécifiques, y compris la température, plages de concentration et de pH. L'identification des paramètres idéaux pour la réaction est essentielle pour soutenir la bio-ingénierie et la production à grande échelle de chlorite dismutase pour éliminer en toute sécurité la chlorite de l'environnement et potentiellement exploiter la génération d'oxygène de l'enzyme.
L'équipe a isolé une souche Cyanothèce non étudiée de chlorite dismutase et a examiné la structure cristalline de la protéine à des valeurs de pH spécifiques pour déterminer l'impact du pH sur la conversion de la chlorite.
Les chercheurs ont utilisé MaNDi, le diffractomètre neutronique macromoléculaire, la ligne 11-B à la source de neutrons de spallation, une installation du Département de l'utilisation de l'énergie à l'ORNL, collecter des données uniques qui ne peuvent être obtenues que par l'utilisation de neutrons.
"Différents cristaux de protéines ont différents degrés de symétrie, qui déterminera comment nous allons les mesurer. Ce cristal est inhabituel en ce qu'il a très peu de symétrie, un nombre particulièrement important de réflexions doit donc être enregistré individuellement pour obtenir un ensemble de données complet, " dit Leighton Coates, Scientifique principal en instrumentation de MaNDi. "Ce serait une tâche difficile et longue n'importe où, et cela n'a été réalisable que dans ce laps de temps en raison de la couverture étendue du détecteur de zone de l'instrument MaNDi. »
Sur MaNDi, les chercheurs ont pu détecter les états de protonation d'acides aminés importants censés soutenir la réaction. La « protonation » fait référence à une étape fondamentale de la catalyse au cours de laquelle l'hydrogène se fixe aux molécules. "C'est la région importante de la protéine, où la chimie se produit et le chlorite se décompose, " dit Coates.
Les états de protonation ne sont pas faciles à observer car ils impliquent de l'hydrogène, ce qui est difficile à détecter avec des rayons X ou d'autres techniques. En outre, un phénomène appelé "photoréduction" se produit lors de l'exposition d'enzymes contenant des métaux comme la chlorite dismutase aux rayons X, essentiellement changer la structure atomique de l'échantillon.
Parce que les techniques neutroniques n'ont pas ces limitations, ils peuvent fournir aux chercheurs des informations clés qui ne peuvent être obtenues par d'autres méthodes. "Les neutrons sont non destructifs et sensibles aux éléments légers comme l'hydrogène, afin qu'ils puissent fournir des informations exclusives sur la structure atomique des protéines, qui sont en grande partie composés de molécules d'hydrogène, ", a expliqué Coates.
« Et contrairement aux rayons X qui peuvent endommager les protéines délicates, les techniques neutroniques permettent de collecter des données à température ambiante sur une protéine non altérée dans son état actif sans les impacts des rayonnements ionisants et de la photoréduction, " a déclaré Coates. " Cette expérience met vraiment en évidence l'avantage d'utiliser des neutrons pour étudier les protéines. "