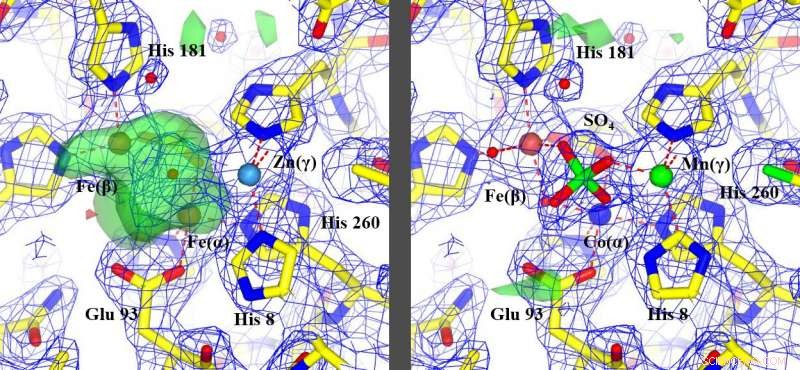
La nouvelle méthode, corriger les métaux mal identifiés, permis la réinterprétation de caractéristiques non identifiées, surligné en vert, (image à gauche) pour identifier le fonctionnement de la protéine, (image à droite). Crédit :Edward Snell
Les protéines qui contiennent du métal, connues sous le nom de métalloprotéines, jouer un rôle important en biologie, régulation de diverses voies dans le corps, qui deviennent souvent la cible de médicaments vitaux. Alors que la quantité de métal dans ces protéines est généralement minime, elle est cruciale pour déterminer la fonction de ces molécules complexes.
Les scientifiques savent depuis longtemps que les métalloprotéines sont vitales pour comprendre les maladies, comme le cancer, et pour développer de nouveaux médicaments puisque des inhibiteurs de métalloprotéines ont été utilisés pour traiter des maladies allant du cancer et du VIH/SIDA aux infections bactériennes et à l'hypertension. Mais il n'y a pas eu de fiabilité, méthode analytique pour déterminer l'identité et la quantité d'atomes métalliques dans les métalloprotéines.
Maintenant, dans une étude publiée le mois dernier dans le Journal de l'American Chemical Society , une équipe internationale de chercheurs rapporte avoir développé un moyen d'identifier et de compter sans ambiguïté les atomes de métal dans les protéines de manière efficace et routinière. En l'utilisant, l'équipe, qui comprenait des scientifiques de l'Université de Buffalo, Hauptman-Woodward Medical Research Institute et d'autres - ont révélé de nouvelles informations qui étaient là, mais auparavant caché.
Appelé émission induite par les particules de rayons X, ou PIXE, la méthode a été développée pour la première fois dans les années 1990 par Elspeth F. Garman de l'Université d'Oxford et Geoffrey W. Grime de l'Université de Surrey Ion Beam Centre, les deux auteurs sur le présent article.
La percée rapportée dans le présent article est le développement de la méthode en une approche efficace à haut débit et la combinaison avec d'autres données expérimentales pour identifier le type et la position précise des métaux dans les protéines. Cela permet de nombreux types de protéines, dont un grand nombre composent la vie telle que nous la connaissons, à analyser rapidement et efficacement, et fournit de nouvelles informations pour une meilleure compréhension structurelle.
L'équipe a appliqué la nouvelle méthode à 30 métalloprotéines sélectionnées au hasard, qui se trouvent déjà dans le référentiel mondial de structures protéiques appelé Protein Data Bank. Ce qui s'est passé ensuite les a choqués.
"Le résultat était bluffant"
"Je me suis assis à Buffalo avec mon collaborateur d'Oxford et quand nous avons calculé les chiffres, nous avons tous les deux immédiatement réalisé que nous avions fait une découverte, " se souvient Edward Snell, Doctorat., l'un des auteurs correspondants, qui est président et chef de la direction de Hauptman-Woodward et professeur au Département de conception et d'innovation des matériaux, un programme conjoint de l'École d'ingénierie et des sciences appliquées de l'UB et de son Collège des arts et des sciences. "Nous avons transformé les chiffres en une image et caché dans les données se trouvait une explication du fonctionnement de cette machine moléculaire.
"Nous avons été les premiers au monde à voir ce qui s'y cachait tout le temps. Le résultat était époustouflant."
Les résultats ont montré que les méthodes précédemment utilisées pour déterminer certaines de ces 30 structures protéiques aléatoires avaient soit mal identifié l'atome de métal, soit, dans certains cas, l'a complètement raté.
« D'après nos résultats, la connaissance actuelle d'environ la moitié des échantillons que nous avons étudiés est incorrecte, " dit Snell.
Les chercheurs ont noté que la banque de données sur les protéines est une ressource essentielle pour les chercheurs du monde entier. En 2017, il y avait en moyenne 1,86 million de téléchargements par jour rien qu'aux États-Unis. Ils notent qu'un nombre énorme de chercheurs utilisent des structures de la banque de données sans connaître les erreurs fondamentales potentielles qui peuvent être présentes.
Et actuellement, plus de 30% des modèles de banques de données contiennent un métal.
De profondes implications
"L'extrapolation de nos résultats dans lesquels il y avait un métal mal identifié dans au moins la moitié des échantillons étudiés suggère que plus de 350, 000 modèles téléchargés par jour peuvent ne pas contenir le bon métal, " Snell a déclaré. "Cela a des implications profondes pour ceux qui utilisent les modèles. Si ces modèles sont faux, la compréhension des millions de personnes qui les utilisent devient imparfaite."
Snell a expliqué que l'une des difficultés dans l'étude des métaux dans les protéines est qu'ils sont très sensibles aux rayons X, donc l'expérience elle-même peut changer ce que vous voyez. Mais il a noté, une technique utilisant des lasers à électrons libres à rayons X (XFEL), empêche cela parce que les expériences sont généralement plus rapides que tout changement qui peut se produire.
Snell dirige le National Science Foundation BioXFEL Science and Technology Center, (Biology with X-ray Free Electron Lasers) un consortium d'UB, Hauptman-Woodward et leurs partenaires. Le centre est dédié à l'utilisation des XFEL, qui produisent des rayons X incroyablement intenses en impulsions extrêmement courtes, et peut aider à la compréhension précise de ces métaux dans les systèmes biologiques.
Sur la base de son expérience avec le centre de criblage par cristallisation à haut débit de Hauptman-Woodward, Snell a collaboré pour mettre en œuvre la technique PIXE dans un environnement à haut débit. Il a utilisé sa connaissance des propriétés des rayons X pour identifier que de nouvelles informations structurelles étaient présentes dans les données, puis a pris cette connaissance et l'a transformée en un résultat structurel.
"Essentiellement, mes collègues ont identifié les métaux et notre travail à Buffalo leur a montré où les mettre, révélant les nouvelles informations qui sont devenues disponibles lorsque le métal dans le modèle était correct, " il a dit.