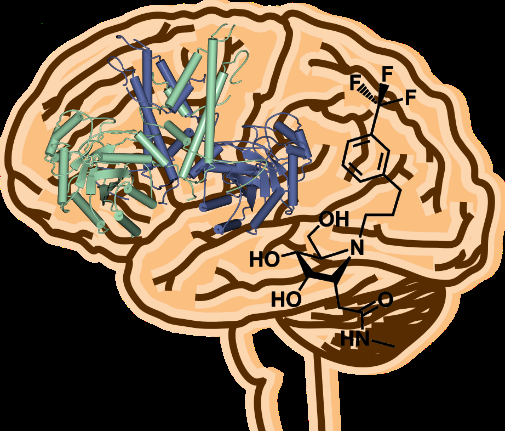
Les médicaments peuvent être conçus sur la base de la structure 3D de cette enzyme humaine. Crédit :Université de York
Chercheurs de l'Université de York et de l'Université Simon Fraser, Canada, a révélé la structure 3-D d'une enzyme qui pourrait constituer une avancée cruciale dans le traitement des maladies neurodégénératives.
Les travaux antérieurs de ces équipes de recherche ont étudié une classe de maladies appelées tauopathies, qui se produisent lorsque les protéines tau se regroupent spontanément dans le cerveau. Elle est souvent associée à la maladie d'Alzheimer et à d'autres maladies neurodégénératives.
Des recherches ont montré que la protéine tau peut être modifiée par un sucre, naturel du corps, appelé O-GlcNAc. Ce sucre peut stabiliser la protéine pour l'empêcher de s'agglomérer et peut ainsi prévenir la maladie. L'enzyme humaine O-GlcNAc-hydrolase, cependant, est responsable de l'élimination de ce sucre crucial de la protéine, ce qui en fait une cible de choix pour prévenir la progression des démences liées à la tau.
Afin de comprendre comment cette agglutination de tau pourrait être évitée ou réduite en augmentant la O-GlcNAc, des scientifiques de York ont étudié la structure de l'enzyme humaine pour révéler comment elle est organisée pour fonctionner de cette manière.
De nouvelles percées
Professeur Gideon Davies, du Département de chimie de l'Université, a déclaré : « L'inhibition de l'enzyme O-GlcNAc-hydrolase permet aux scientifiques de stabiliser le tau. Nous avons résolu la structure tridimensionnelle de l'enzyme afin de faciliter la conception de médicaments basés sur la structure. L'organisation inhabituelle et complexe devrait nous aider dans la recherche de de nouveaux médicaments pour traiter les maladies neurodégénératives.
"Les médicaments peuvent être conçus sur la base de la structure 3-D de cette enzyme humaine, qui ouvrira à terme la voie à de nouvelles avancées dans le traitement de maladies telles que la maladie d'Alzheimer."
Professeur David Vocadlo, de l'Université Simon Fraser, a déclaré : « En plus de servir de modèle pour le développement d'antagonistes, cette structure longtemps recherchée révèle une architecture surprenante qui peut conduire à une meilleure compréhension de la façon dont cette enzyme importante est régulée dans les cellules. De telles informations pourraient conduire à des thérapies plus ciblées pour diverses maladies. »
Clé d'une serrure
Dr Rosa Sancho, Responsable de la recherche à Alzheimer's Research UK qui a financé en partie ce travail, a déclaré : « La découverte de médicaments, c'est un peu comme concevoir une clé pour s'adapter à une serrure, cependant, il est important de connaître la forme de la serrure avec laquelle vous travaillez. Cette nouvelle étude décrit en détail la forme de l'O-GlcNAc-hydrolase et ouvre la voie à la conception de médicaments pouvant s'adapter à ce verrou. De futures études devront déterminer si les médicaments capables d'inhiber cette enzyme sont prometteurs pour le traitement de la maladie d'Alzheimer et d'autres démences, mais c'est un pas important dans la bonne direction.
"Avec 850, 000 personnes au Royaume-Uni vivant actuellement avec la démence et aucun nouveau traitement autorisé au cours de la dernière décennie, il y a un besoin urgent de stratégies nouvelles et innovantes pour s'attaquer de front à la maladie."
La recherche est publiée dans Nature Chimie Biologie .