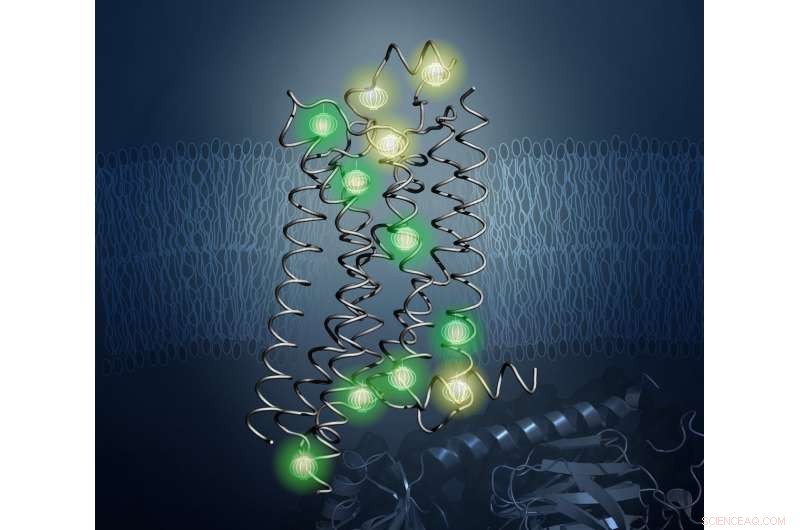
Les sondes (montrées brillantes ici) ont révélé l'architecture interne de la protéine A2aAR dans la nouvelle étude. Crédit :Kurt Wuthrich et Matthew Eddy, L'institut de recherche Scripps
Les scientifiques du Scripps Research Institute (TSRI) ont scruté le cœur d'une protéine clé utilisée dans la conception de médicaments et découvert des caractéristiques structurelles dynamiques qui pourraient conduire à de nouvelles façons de cibler les maladies. La protéine, appelé le A
Le nouveau, image plus détaillée de A
"Ces connaissances de base sont potentiellement utiles pour améliorer la conception de médicaments, " déclare le prix Nobel Kurt Wthrich, Doctorat, le professeur Cecil H. et Ida M. Green de biologie structurale au TSRI et auteur principal de l'étude.
Les résultats ont été publiés aujourd'hui dans la revue Cellule .
Une technique d'imagerie révèle comment la protéine change de forme
Toutes les cellules humaines contiennent A
"Les GPCR font à peu près tout ce que vous pouvez imaginer, " dit Wthrich. " Mais pendant longtemps, la conception de médicaments était faite sans savoir à quoi ressemblaient les GPCR. »
Pour la nouvelle étude, les chercheurs ont cherché à mieux comprendre la relation entre A
La recherche s'est appuyée sur des études antérieures où les scientifiques ont utilisé une technique d'imagerie appelée cristallographie aux rayons X pour déterminer A
Bien que les structures cristallines aient fourni un aperçu clé de la forme du récepteur dans les états inactifs et actifs, ils ne pouvaient pas montrer le mouvement et les changements de structure quand A
Pour résoudre ce problème, les chercheurs ont utilisé une technique appelée spectroscopie de résonance magnétique nucléaire (RMN), qui crée des champs magnétiques puissants pour localiser les positions des sondes dans un échantillon. Wthrich est un leader de renommée mondiale dans le domaine de la RMN et a remporté le prix Nobel de chimie en 2002 pour ses travaux pionniers en RMN pour étudier les structures des molécules biologiques. Avec la RMN, les scientifiques peuvent déterminer les structures des protéines et étudier leurs propriétés dynamiques en solution à des températures physiologiques, telles qu'elles existent dans le corps humain.
Dans le travail dirigé par Matthew Eddy de TSRI, Doctorat, premier auteur de la nouvelle étude, les chercheurs ont utilisé la RMN pour observer A
Surtout, La RMN a permis à l'équipe de visualiser les changements dans l'architecture interne d'A
C'était comme si les chercheurs avaient vu une voiture, et par RMN, ils pouvaient enfin inspecter son moteur.
Repenser la façon dont nous concevons les médicaments
Deux détails en A
"Avec ce constat, nous pouvons dire 'A-ha! C'est ce changement de structure qui tue l'activité de signalisation. Peut-être pouvons-nous modifier un médicament pour dépasser cette limite, " dit Wthrich.
Les chercheurs ont également révélé l'activité d'un "interrupteur à bascule" dans A
Les chercheurs soulignent que cette nouvelle étude est potentiellement pertinente pour une grande partie de la grande famille des GPCR. En réalité, structural details from this study could apply to more than 600 "class A" GPCRs in our bodies.
In addition to Wthrich and Eddy, authors of the study, "Allosteric Coupling of Drug Binding and Intracellular Signaling in the A