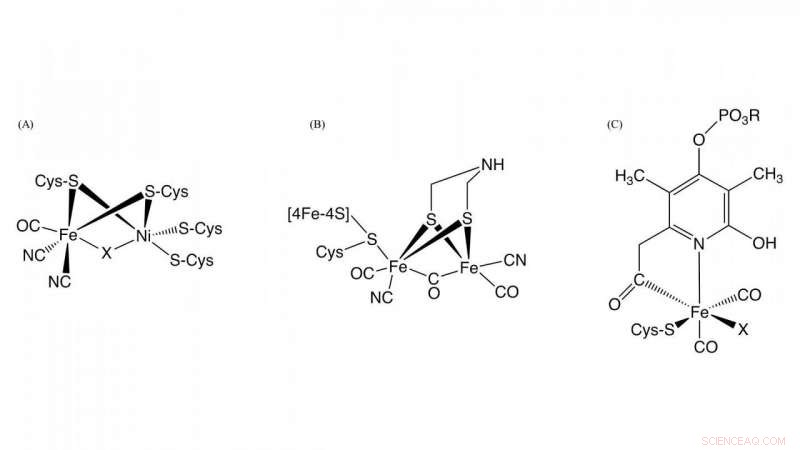
Figure 1. Structure des sites actifs dans la [NiFe]-hydrogénase, [FeFe]-hydrogénase, et [Fe]-hydrogénase Crédit :NINS/IMS
Un groupe de recherche comprenant des chercheurs du Centre de recherche exploratoire sur la vie et les systèmes vivants (ExCELLS), Institut des sciences moléculaires (IMS) des Instituts nationaux des sciences naturelles, et l'Université d'Osaka ont révélé le mécanisme détaillé de la biosynthèse du monoxyde de carbone essentiel à la maturation du site actif de la NiFe-hydrogénase.
Hydrogénase, qui est une métalloenzyme responsable de l'oxydation de l'hydrogène gazeux et de la réduction des protons, joue un rôle clé dans le métabolisme de l'hydrogène bactérien. Sur la base des différences de teneur en métal sur le site actif, ils sont classés en trois groupes :NiFe-, FeFe-, et Fe-hydrogénases contenant différents complexes métalliques en tant que centres actifs dans ces enzymes (Figure 1). Bien que les structures de leurs centres actifs soient différentes, il est essentiel pour l'activité hydrogénase que le monoxyde de carbone (CO) soit coordonné à l'ion fer dans le centre actif. On sait que le CO est biosynthétisé par une réaction enzymatique, mais le détail de la biosynthèse du CO était inconnu.
Dans cette recherche, le groupe a déterminé la structure cristalline de l'enzyme (HypX) responsable de la biosynthèse du CO (Figure 2), sur la base duquel HypX biosynthétise le CO par une réaction sans précédent pour la maturation de la NiFe-hydrogénase. HypX se compose de deux domaines :les domaines N-terminal et C-terminal. Une cavité continue reliant les domaines N- et C-terminaux est présente à l'intérieur de HypX (Figure 2). Dans la structure cristalline, la coenzyme A (CoA) est liée à la région C-terminale de la cavité.
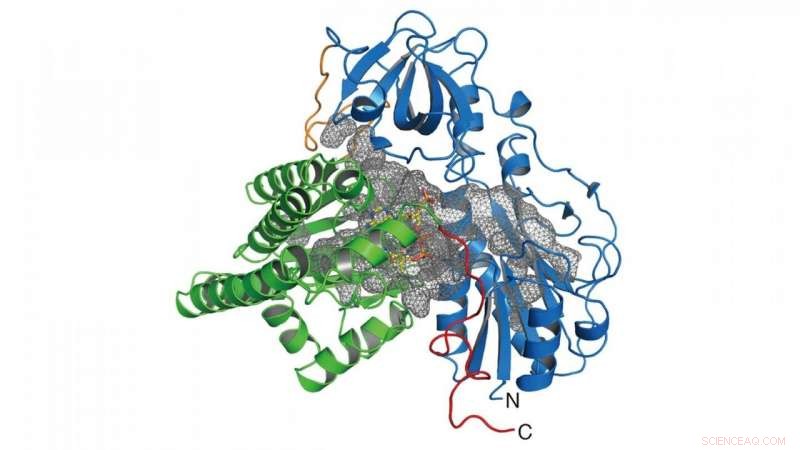
Figure 2. Structure cristalline de HypX. Les domaines N- et C-terminaux sont représentés en bleu et vert, respectivement. La cavité à l'intérieur de HypX est représentée dans un maillage gris. Crédit :NINS/IMS
Deux réactions différentes se produisent dans les domaines N- et C-terminaux. Dans le domaine N-terminal, une réaction de transfert de groupe formyle à partir de formyltétrahydrofolate, qui est lié dans la région N-terminale de la cavité en tant que substrat au CoA, a lieu (étape de réaction 1 sur la figure 3). En ce moment, CoA dans la cavité adopte la conformation linéaire étendue, et le groupe SH de CoA est situé près du groupe formyle dans le formyltétrahydrofolate lié dans le domaine N-terminal. Puis, le formyl-CoA est produit comme intermédiaire de réaction par la réaction de transfert du groupe formyle du formyltétrahydrofolate au CoA.
A l'étape suivante, le formyl-CoA subit un grand changement de conformation dans la cavité de sorte que le groupe formyl en position terminale du formyl-CoA est situé sur le site actif dans le domaine C-terminal de HypX (étape de réaction 2 sur la figure 3). Dans le domaine C-terminal, Le CO est formé par décarbonylation du formyl-CoA (étape de réaction 3 sur la figure 3).
Cette réaction de biosynthèse du CO est la réaction inédite et inédite. Le CoA est bien connu comme coenzyme, qui a un rôle important dans le métabolisme des acides gras et le métabolisme énergétique cellulaire à travers le cycle de l'acide citrique. Cependant, il n'a jamais été rapporté que le CoA/formyl-CoA est impliqué dans les réactions de biosynthèse du CO. Cette recherche a révélé une nouvelle fonction physiologique d'une coenzyme CoA bien connue.
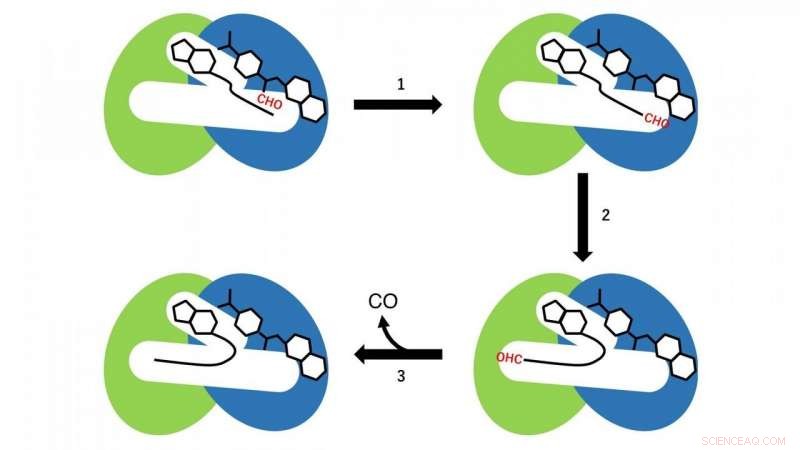
Figure 3. Schéma réactionnel de la biosynthèse du CO par HypX. Les domaines N- et C-terminaux sont représentés respectivement en bleu et en vert. Le groupe formyle (CHO) est indiqué en rouge. Crédit :NINS/IMS
Perspectives d'avenir:
Les mécanismes de biosynthèse des métalloenzymes restent inconnus dans de nombreux cas. Il reste à élucider en particulier comment les centres actifs contenant des métaux des métalloenzymes ont été assemblés. Dans ce travail, nous avons déterminé la première structure cristalline de l'enzyme qui catalyse la réaction de biosynthèse du monoxyde de carbone essentielle à la construction du site actif de l'hydrogénase [NiFe]. À l'avenir, nous poursuivrons les recherches pour élucider le mécanisme détaillé de l'ensemble de la voie de maturation de l'hydrogénase sur la base de ce résultat.