Crédit :FV Berlin
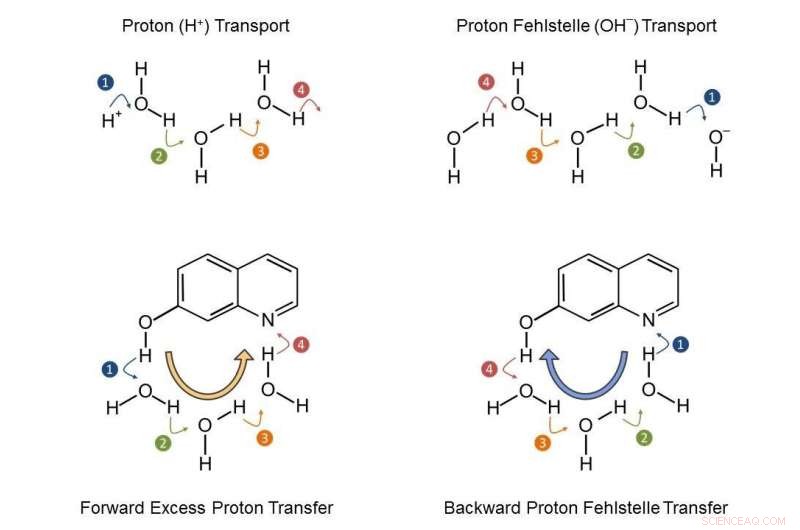
Une étude collaborative de spectroscopie ultrarapide et de simulations de dynamique moléculaire ab initio montre que les lacunes de protons sous forme d'ions hydroxyde/méthoxyde sont aussi pertinentes pour le transfert de protons entre acides et bases que les protons en excès hydratés (H
L'échange de protons entre deux groupes chimiques (neutralisation acide-base) est un problème de chimie classique depuis de nombreuses années. Étonnamment, à ce jour, de nouvelles informations fondamentales sur les étapes élémentaires du transport des protons n'ont pas été obtenues. Cela peut bien résider dans le fait que les étapes élémentaires (par protons ou lacunes de protons) se déroulent sur des échelles de temps extrêmement courtes, qui ne sont pas accessibles avec les techniques de laboratoire conventionnelles (Figure 1). Observation de ces étapes réactionnelles élémentaires, tel que réalisé par les équipes de recherche de MBI et MLU nécessite donc un accès direct à des échelles de temps de 1-100 picosecondes (0.000000000001 jusqu'à 0.0000000001 secondes), nécessitant une installation expérimentale avec une résolution temporelle en conséquence élevée ainsi que des systèmes informatiques de haute performance.
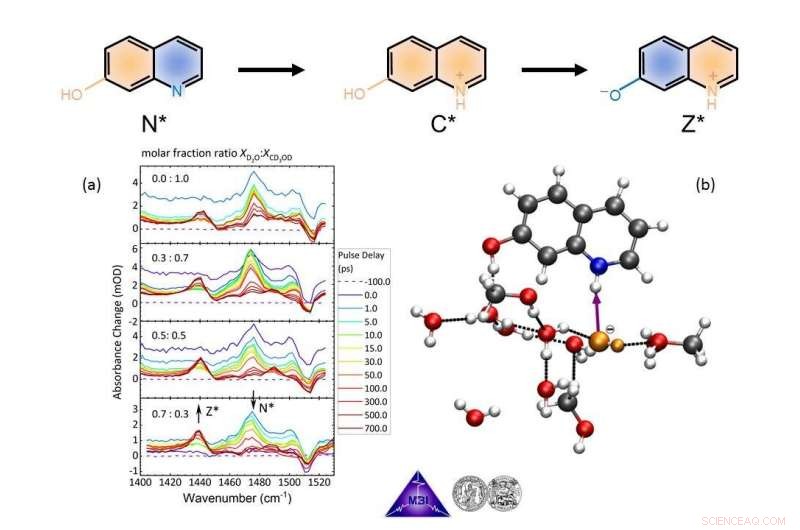
Les équipes de recherche ont étudié conjointement un système modèle particulier (7-hydroxyquinoléine dans des mélanges eau/méthanol), où une impulsion laser ultracourte déclenche la déprotonation d'un groupe OH et la protonation d'un atome d'azote. La chronologie précise des étapes élémentaires avec cette classe de réactions chimiques est restée insaisissable, donnant lieu à de nombreuses spéculations. Les scientifiques du MBI et du MLU ont maintenant pu déterminer que la libération d'un proton du groupe OH vers le solvant est en effet ultrarapide, pourtant la captation d'un proton par l'atome d'azote est encore plus rapide. Il en résulte un mécanisme de transport des lacunes de protons, c'est-à-dire d'ions hydroxyde/méthoxyde. Les étapes élémentaires de la réaction ont été élucidées avec des spectres IR résolus en temps et des calculs de chimie quantique détaillés (voir Figure 2).
Surveillance du transport de protons de la 7-hydroxyquinoléine dans des mélanges de solvants eau/méthanol en temps réel depuis le réactif neutre N* via le cation intermédiaire C* jusqu'au produit zwitterionique Z* avec spectroscopie pompe UV/sonde IR des modes marqueurs actifs IR ( une), et suivre des trajectoires de dynamique moléculaire ab initio (b). L'instantané en (b) montre le moment où la première étape de réaction, abstraction de protons d'une molécule d'eau voisine par l'atome d'azote de la 7-hydroxyquinoléine (ci-dessus, atome bleu), vient de se produire et un ion OH– (orange) s'est formé, entouré d'autres molécules de solvant. Crédit :FV Berlin