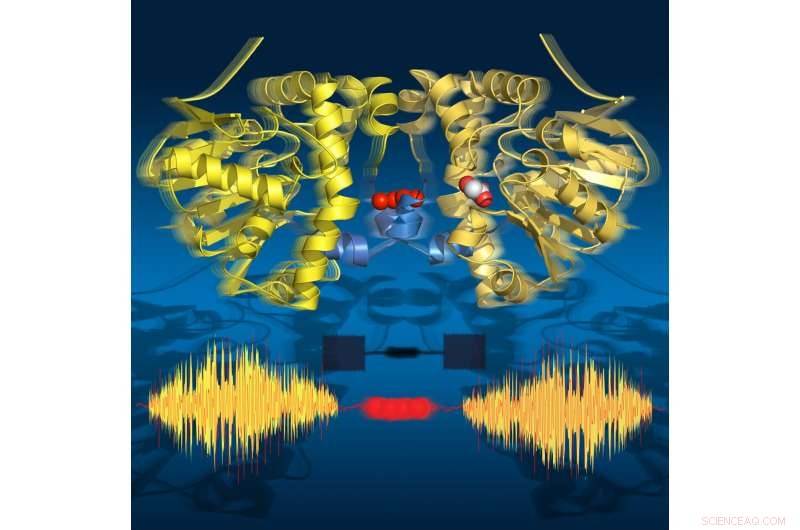
Les images en accéléré montrent que l'enzyme « respire » pendant le renouvellement :elle se dilate et se contracte conformément aux sous-étapes catalytiques. Ses deux moitiés communiquent via une chaîne de molécules d'eau. Crédit :Joerg M. Harms, MPSD
Des chercheurs du Département de dynamique résolue atomiquement de l'Institut Max Planck pour la structure et la dynamique de la matière (MPSD) au Centre for Free-Electron Laser Science à Hambourg, l'Université de Potsdam (toutes deux en Allemagne) et l'Université de Toronto (Canada) ont reconstitué un film détaillé en accéléré révélant toutes les étapes majeures du cycle catalytique d'une enzyme. Étonnamment, la communication entre les unités protéiques s'effectue via un réseau d'eau semblable à un téléphone à cordes. Cette communication est alignée sur un mouvement de « respiration », c'est l'expansion et la contraction de la protéine. Cette séquence de structures en accéléré révèle les mouvements dynamiques comme un élément fondamental des fondements moléculaires de la biologie.
Toute vie est dynamique, tout comme ses éléments constitutifs moléculaires. Les mouvements et les changements structurels des biomolécules sont fondamentaux pour leurs fonctions. Cependant, comprendre ces mouvements dynamiques au niveau moléculaire est un formidable défi. Comment une protéine est-elle capable d'accélérer une réaction chimique, qui prendrait des années à avancer sans aide ?
À cette fin, les chercheurs se sont tournés vers une enzyme qui sépare la liaison simple la plus forte de la chimie organique :la liaison C-F. Les carbones fluorés peuvent être trouvés dans des matériaux tels que le Teflon ou le GoreTex et dans de nombreux produits pharmaceutiques et pesticides. Les composés fluorés ont une influence particulière sur le changement climatique, dépassement de l'efficacité du CO
Les chercheurs ont utilisé la cristallographie aux rayons X à résolution temporelle pour prendre des instantanés moléculaires pendant la réaction de renouvellement de cette enzyme naturelle à des températures physiologiques. Ce film en accéléré a révélé dix-huit points de temps de 30 millisecondes à 30 secondes, couvrant tous les états catalytiques clés qui conduisent à la rupture de la liaison C-F. Étonnamment, le film montre également que l'enzyme "respire" pendant le renouvellement, c'est-à-dire qu'il se dilate et se contracte aligné avec les sous-étapes catalytiques.
Étonnamment, les deux moitiés de l'enzyme communiquent entre elles via une chaîne de molécules d'eau qui relie les deux moitiés. Ce réseau d'eau permet aux deux moitiés de « parler » entre elles et de partager des informations sur leur état catalytique. Ceci est crucial pour la fonction de l'enzyme car seule la moitié de l'enzyme peut être active à un moment donné.
Ces changements dynamiques se sont avérés cruciaux pour la fonction de l'enzyme. Les chercheurs s'attendent à ce que de nombreux autres systèmes exploitent des mécanismes similaires pour leurs activités.