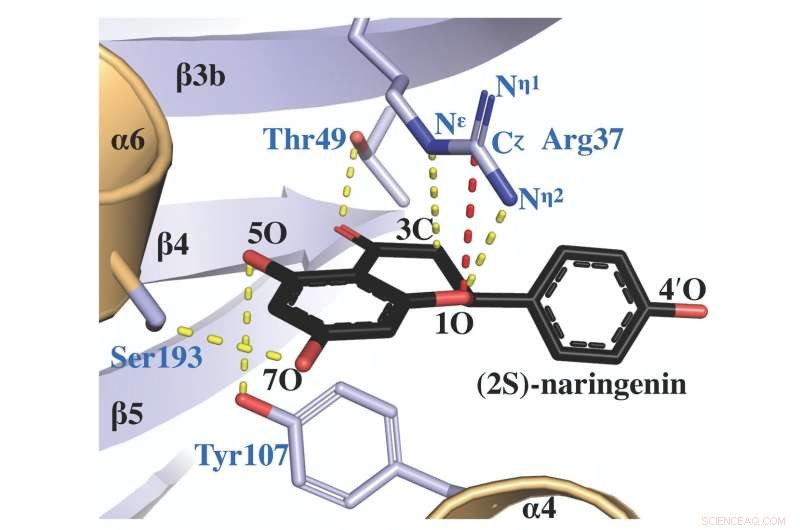
La structure cristalline aux rayons X de la protéine de la chalcone isomérase, complexé avec une molécule de produit appelée (2S)-naringénine, révèle comment l'arginine du site actif (étiquetée Arg 37) facilite la catalyse de l'isomère correct. Crédit :Salk Institute/ACS Catalyse
Les plantes peuvent faire beaucoup de choses incroyables. Parmi leurs talents, ils peuvent fabriquer des composés qui les aident à repousser les parasites, attirer les pollinisateurs, guérir les infections et se protéger des températures excessives, sécheresse et autres risques environnementaux.
Des chercheurs du Salk Institute qui étudient comment les plantes ont développé leurs capacités à fabriquer ces produits chimiques naturels ont découvert comment une enzyme appelée chalcone isomérase a évolué pour permettre aux plantes de fabriquer des produits essentiels à leur propre survie. Les chercheurs espèrent que ces connaissances éclaireront la fabrication de produits bénéfiques pour l'homme, y compris les médicaments et les cultures améliorées. L'étude a été publiée dans la version imprimée de Catalyse ACS le 6 septembre, 2019.
"Depuis que les plantes terrestres sont apparues sur terre il y a environ 450 millions d'années, ils ont développé un système métabolique sophistiqué pour transformer le dioxyde de carbone de l'atmosphère en une myriade de produits chimiques naturels dans leurs racines, pousses et graines, " dit le professeur Salk Joseph Noel, l'auteur principal de l'article. "C'est l'aboutissement du travail que nous effectuons dans mon laboratoire depuis 20 ans, essayer de comprendre l'évolution chimique des plantes. Cela nous donne des connaissances détaillées sur la façon dont les plantes ont développé cette capacité unique à fabriquer des molécules très inhabituelles mais importantes. »
Des recherches antérieures dans le laboratoire Noel ont examiné comment ces enzymes ont évolué à partir de protéines non enzymatiques, y compris l'étude de versions plus primitives d'entre eux qui apparaissent dans des organismes tels que les bactéries et les champignons.
En tant qu'enzyme, la chalcone isomérase agit comme un catalyseur pour accélérer les réactions chimiques dans les plantes. Cela permet également de s'assurer que les produits chimiques fabriqués dans l'usine sont sous la forme appropriée, puisque les molécules ayant la même formule chimique peuvent prendre deux variations différentes qui sont des images miroir l'une de l'autre (appelées isomères).

Salk Professeur Joseph Noël, photographié dans son laboratoire, à côté d'un appareil de spectroscopie RMN, qui est utilisé pour déchiffrer le détail des structures électroniques des molécules. Crédit :Institut Salk
« Dans l'industrie pharmaceutique, il est important que les médicaments fabriqués soient la bonne version, ou isomère, parce que l'utilisation du mauvais peut entraîner des effets secondaires inattendus, " dit Noël, qui est directeur du Centre Jack H. Skirball de Salk pour la biologie chimique et la protéomique et titulaire de la chaire Arthur et Julie Woodrow. "En étudiant le fonctionnement de la chalcone isomérase, nous pouvons en savoir plus sur la façon d'accélérer la fabrication des bons isomères de produits pharmaceutiques et d'autres produits qui peuvent être importants pour la santé humaine."
Dans l'étude actuelle, les chercheurs ont utilisé plusieurs techniques de biologie structurelle pour étudier la forme unique de l'enzyme et comment sa forme change lorsqu'elle interagit avec d'autres molécules. Ils ont identifié la partie de la structure de la chalcone isomérase qui lui a permis de catalyser des réactions incroyablement rapidement tout en s'assurant qu'elle fait le bon, isomère biologiquement actif. Ces réactions conduisent à une multitude d'activités dans les plantes, y compris la conversion de métabolites primaires comme la phénylalanine et la tyrosine en molécules spécialisées vitales appelées flavonoïdes.
Il s'est avéré qu'un acide aminé particulier, arginine, c'était l'un des nombreux acides aminés liés entre eux dans la chalcone isomérase assis dans un endroit, façonné par l'évolution, qui lui a permis de jouer un rôle clé dans la façon dont les réactions de l'isomérase chalcone ont été catalysées.
"En faisant des études de structure et de modélisation informatique, nous pouvions voir les positions très précises de l'arginine au sein du site actif de l'enzyme au fur et à mesure que la réaction se déroulait, " dit le premier auteur Jason Burke, une ancienne recherche postdoctorale dans le laboratoire de Noel qui est maintenant professeur adjoint à la California State University San Bernardino. "Sans cette arginine, ça ne marche pas de la même façon."
Burke ajoute que ce type de catalyseur a été longtemps recherché par les chimistes organiques. "C'est un exemple de la nature qui résout déjà un problème que les chimistes étudient depuis longtemps, " il ajoute.
"En comprenant la chalcone isomérase, nous pouvons créer un nouvel ensemble d'outils que les chimistes pourront utiliser pour les réactions qu'ils étudient, " dit Noel. " Il est absolument vital d'avoir ce genre de connaissances fondamentales pour pouvoir concevoir des systèmes moléculaires qui peuvent effectuer une tâche particulière même dans la prochaine génération de cultures nutritionnellement denses capables de transformer le gaz à effet de serre dioxyde de carbone en molécules essentielles pour la vie."