Illustration. Argent. Crédit :@tsarcyanide/MIPT
Des chercheurs de l'Institut de physique et de technologie de Moscou se sont associés à des collègues de Russie et d'Arabie saoudite et ont proposé une méthode efficace pour obtenir les données fondamentales nécessaires à la compréhension des processus chimiques et physiques impliquant des substances à l'état gazeux. Le protocole numérique proposé prédit l'effet thermique de la formation en phase gazeuse de composés d'argent et leur entropie absolue. Cela inclut les toutes premières données de ce type pour plus de 90 composés. Publié dans la revue Chimie inorganique , les résultats sont importants pour les applications pratiques de substances contenant de l'argent, y compris dans l'eau et la désinfection des plaies, photographie et ensemencement de nuages.
L'équipe a dérivé les valeurs précises de l'enthalpie de formation et de l'entropie de nombreux composés d'argent. L'enthalpie (du grec "thalpein, " signifiant " chauffer ") d'un système décrit son état en termes d'énergie des particules constitutives, pression et volume. Selon la loi de Hess, la multiplication des coefficients stoechiométriques et la différence entre les enthalpies de formation des réactifs et celles des produits donne la quantité de chaleur générée ou consommée dans une réaction chimique. L'entropie est une mesure de la façon dont un système est désordonné. La deuxième loi de la thermodynamique stipule qu'un système peut adopter spontanément un état moins organisé, donc l'entropie augmente avec le temps.
Connaître les valeurs de l'enthalpie et de l'entropie est crucial pour prédire si une réaction se produira un jour dans des conditions données. Ces caractéristiques indiquent également comment le rendement et la sélectivité de la réaction - le rapport entre les produits - varient avec la température et la pression, permettant l'optimisation. Les résultats permettent aux chercheurs de faire des prédictions concernant les processus chimiques se produisant en phase gazeuse. Les données aideront également à gérer les processus impliqués dans le dépôt de couches minces et d'échantillons purs à partir de la phase gazeuse.
Il existe essentiellement deux manières de déterminer les changements d'enthalpie et d'entropie - soit par des expériences complexes et coûteuses, ou en utilisant les données d'ouvrages de référence et en faisant des calculs basés sur la loi de Hess.
« Le choix semble évident, d'autant plus que vous ne pouvez pas mesurer expérimentalement la chaleur de certaines réactions, " dit Iouri Minenkov, chercheur senior au Laboratoire des méthodes de calcul intensif en physique de la matière condensée. "Par exemple, la combustion incomplète du graphite produit toujours à la fois du monoxyde de carbone et du dioxyde de carbone. Ainsi, même en mesurant l'effet thermique de la réaction, nous n'avons pas pu déterminer l'enthalpie de formation de monoxyde de carbone.
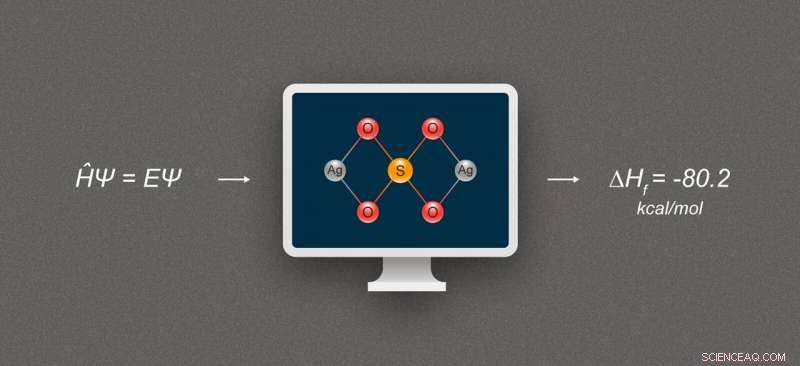
Figure 1. Diagramme simplifié illustrant le calcul de l'enthalpie de formation pour les composés d'argent. Le composé représenté est le sulfate d'argent, Ag₂SO₄. Crédit :@tsarcyanide/MIPT
"Mais l'approche computationnelle se heurte à certains problèmes, " Minenkov poursuivit. " D'abord, les enthalpies de formation et les entropies ne sont pas connues pour chaque composé. Seconde, même si les données sont disponibles, personne ne peut garantir leur exactitude. Les valeurs varient considérablement entre les livres de référence. A l'heure, les erreurs de mesure peuvent être assez importantes."
Heureusement, la chimie quantique permet d'obtenir l'entropie et, dans une certaine mesure, les données d'enthalpie. Chaque molécule constitutive d'une substance gazeuse peut être considérée comme un système de noyaux chargés positivement et d'électrons chargés négativement. Les chercheurs peuvent ensuite appliquer des méthodes de calcul de structure électronique pour résoudre l'équation moléculaire de Schrödinger. Cela révèle l'énergie électronique totale de la molécule, sa fonction d'onde, et la configuration spatiale des noyaux, c'est-à-dire sa structure géométrique 3-D. Les physiciens peuvent alors calculer l'entropie et l'enthalpie d'un gaz parfait composé de telles molécules. Les valeurs d'entropie ainsi obtenues sont ensuite introduites dans des ouvrages de référence et utilisées dans les calculs thermodynamiques.
Le problème avec l'enthalpie est que, n'étant pas une valeur fondamentale à ce stade, cela dépend de manière significative de la méthode choisie pour le calcul de l'équation de Schrödinger.
Les réactions d'atomisation sont généralement utilisées pour calculer l'enthalpie de formation. Dans de telles réactions, le composé d'intérêt se décompose en atomes individuels. Par exemple, sulfure d'argent—Ag
Cependant, lorsque des molécules composées de nombreux atomes subissent une atomisation, cela affecte la structure électronique à un point tel que l'enthalpie, trop, est considérablement modifié. Les méthodes actuellement disponibles de la chimie théorique ne peuvent pas rendre compte de ces effets avec suffisamment de précision.
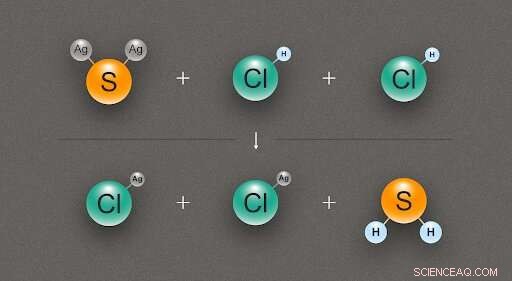
Figure 2. Un schéma illustrant la réaction chimique entre une molécule de sulfure d'argent (Ag₂S) et deux molécules d'acide chlorhydrique (HCl), produisant deux molécules de chlorure d'argent (AgCl) et une de sulfure d'hydrogène (H₂S). Crédit :@tsarcyanide/MIPT
L'équipe de chercheurs du MIPT, l'Institut Frumkin de chimie physique et d'électrochimie de l'Académie des sciences de Russie, Université d'État de chimie et de technologie d'Ivanovo, et l'Université des sciences et technologies du roi Abdallah d'Arabie saoudite a publié une série d'articles proposant un moyen de calculer les caractéristiques thermodynamiques des composés organiques et inorganiques avec plus de précision.
Dans le cas du sulfure d'argent, les chercheurs ont trouvé son enthalpie de formation à partir de la réaction avec l'acide chlorhydrique, ce qui donne du chlorure d'argent et du sulfure d'hydrogène (fig. 2). Étant donné que le nombre d'obligations dans la rangée du haut est le même que dans la rangée du bas, le changement d'énergie peut être calculé avec la moindre erreur.
La chaleur de formation du chlorure d'argent, sulfure d'hydrogène, et l'acide chlorhydrique sont connus avec une grande précision, et la modélisation informatique révèle l'effet thermique de la réaction. A partir de ces données, il est possible de dériver la chaleur de formation du sulfure d'argent en utilisant la loi de Hess.
"L'approche classique des clusters couplés, connu sous le nom de CCSD(T), est l'étalon-or pour résoudre l'équation électronique de Schrödinger en chimie quantique moderne, " expliqua Minenkov. " Nous l'avons remplacé par la version locale appelée DLPNO-CCSD(T), qui a été développé il n'y a pas si longtemps à l'Institut Max Planck. Cela a réduit la puissance de calcul requise d'un ordre de grandeur. Dans le cadre du CCSD(T) conventionnel, le temps de calcul varie avec la taille N de la molécule comme N 7 , ce n'est donc pas une option pour les grosses molécules. La version locale prend beaucoup moins de temps et de ressources."
L'équipe a commencé par vérifier dans quelle mesure les résultats de leurs calculs de chimie quantique concordaient avec les données thermodynamiques et structurelles expérimentales. Les ouvrages de référence ont rapporté les valeurs de 10 composés d'argent, et ils étaient un bon match. Après s'être ainsi assuré que leur modèle est adéquat, les chercheurs ont calculé les caractéristiques thermodynamiques de 90 composés d'argent manquants dans les livres. Les données sont utiles à la fois aux scientifiques travaillant dans le domaine de la chimie de l'argent et pour tester et calibrer de nouvelles méthodes de calcul de structure électronique.