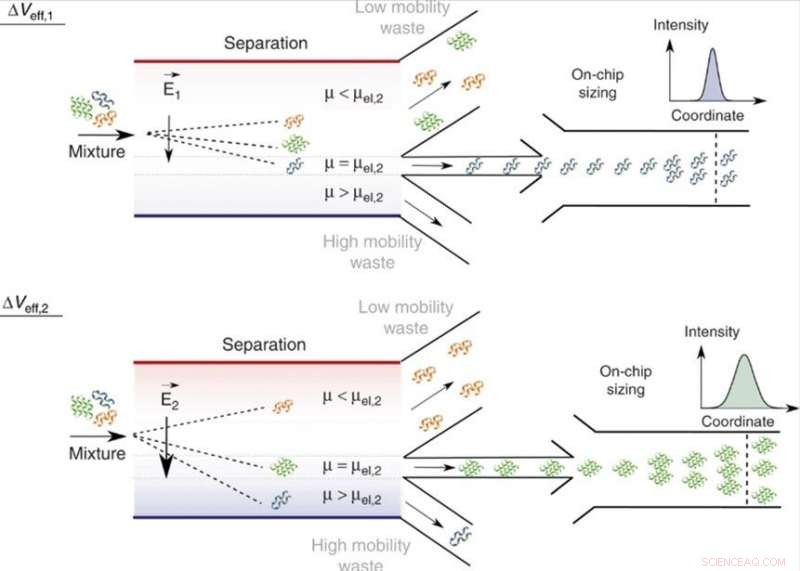
Séparation sur puce et analyse de mélanges en phase liquide. En ajustant la tension efficace, Veff, molécules d'une mobilité électrophorétique spécifique, = μel, et donc d'un rapport charge spécifique sur rayon hydrodynamique, qRh, peuvent être dirigées vers la zone d'analyse avec celles de valeurs de mobilité plus petites (μ < μel) et plus grandes (μ > μel) dirigées vers les canaux de collecte des déchets. Comme la tension appliquée peut être modifiée, une seule unité d'analyse est nécessaire et la largeur de la chambre de séparation peut être maintenue contrainte, permettant à l'appareil de conserver une efficacité de tension élevée et une vitesse de traitement rapide. Dans la zone d'analyse, les fractions sont dimensionnées par dimensionnement diffusionnel microfluidique (MDS) en surveillant leur mouvement spatio-temporel dans des conditions d'écoulement laminaire. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0072-3
Les systèmes microfluidiques sont utilisés en biologie moléculaire, biochimie et biotechnologie pour analyser rapidement des mélanges biomoléculaires hétérogènes avec des taux de récupération élevés et des volumes d'échantillons infimes. Cependant, il est difficile de combiner les processus de préparation et d'analyse au sein d'un seul appareil pour une analyse intégrée rapide. Dans une étude récente maintenant publiée sur Microsystèmes et nano-ingénierie , Kadi L. Saar et ses collaborateurs des départements interdisciplinaires de chimie, la physique, et Fluidic Analytics Limited à Cambridge, ROYAUME-UNI., ont développé une puce combinant les deux étapes de préparation et d'analyse.
Initialement, ils ont utilisé la tension pour séparer les molécules de protéines au sein d'un mélange binaire de biomolécules de taille égale indiscernables via des techniques de dimensionnement ou de résolution conventionnelles. Après, l'équipe de recherche a utilisé le nouveau dispositif pour obtenir une empreinte 2-D d'un mélange de protéines hétérogène. Les résultats ouvriront de nouvelles possibilités pour acquérir des données multiparamétriques rapides sur des systèmes biomoléculaires à court terme.
Les techniques de microfluidique sont intéressantes pour analyser des échantillons biologiques en raison des exigences d'échantillons très faibles et d'un taux de récupération élevé. Les plates-formes peuvent fournir une vitesse d'analyse insurpassable au niveau des unités d'opération individuelles ou fournir à plusieurs unités un flux de travail directement combiné, sans transfert d'échantillons entre les unités. De tels transferts se produisent à travers des connecteurs ou des tubes et introduisent une dispersion dans l'échantillon, affectant les performances du système. Le flux de travail proposé ici peut séparer des mélanges hétérogènes pour déterminer les composants d'intérêt et réduire les complexités pour un traitement ultérieur du mélange pour sa purification.
Les chercheurs avaient précédemment introduit une variété de stratégies de séparation moléculaire basées sur un flux continu à l'échelle du micron, y compris l'électrophorèse à flux libre, diélectrophorèse, magnétophorèse et séparation acoustophorétique. Des stratégies de détection telles que la fluorescence induite par laser ou LED (LIF), Des approches de chimiluminescence ou électrochimiques peuvent être implantées en parallèle au sein de telles plateformes de séparation microfluidique. Les informations analytiques sur les composés séparés peuvent être obtenues avec des stratégies hors ligne telles que la spectroscopie de masse ou SDS-PAGE, mais les techniques peuvent limiter la vitesse de traitement dans un seul appareil, causant la perte ou la contamination de l'échantillon.
Sarre et al. donc développé une séparation entièrement intégrée et une caractérisation quantitative d'échantillons biomoléculaires hétérogènes dans un seul dispositif microfluidique pour surmonter les limites existantes en couplant directement la séparation sur puce à l'analyse sur puce et au dimensionnement moléculaire. La caractéristique de conception a permis l'analyse d'une fraction spécifique en ajustant l'intensité du champ appliqué. Ils ont conçu l'appareil pour identifier des fractions séparées similaires aux méthodes SEC-MALS (chromatographie d'exclusion stérique avec diffusion de la lumière multi-angles) ou LC (puce)-MS ((sur puce)-chromatographie liquide-spectrométrie de masse).
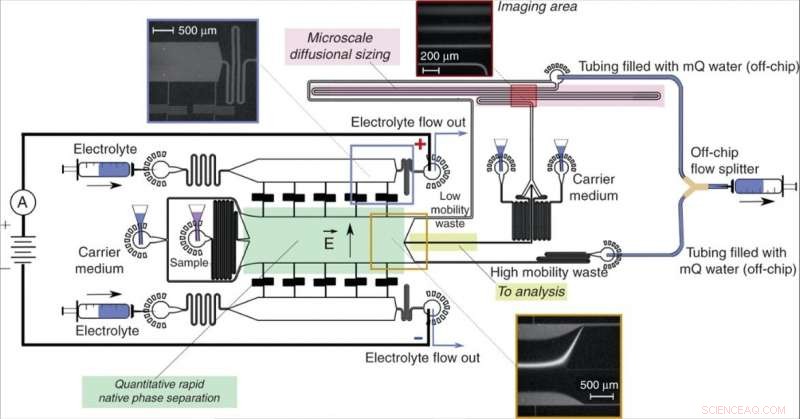
Conception et fonctionnement de l'appareil. Une unité d'électrophorèse à flux libre (vert), permettant une séparation rapide des molécules d'analyte dans leur phase native et fournissant des informations quantitatives sur le processus de séparation, a dirigé des fractions de l'échantillon (jaune) vers un processus d'analyse en aval impliquant un dimensionnement diffusionnel microfluidique (MDS ; rose). L'échantillon a été caractérisé en surveillant une seule trame d'imagerie (encadré en haut à droite) pour extraire simultanément les tailles et les charges des fractions séparées. L'appareil fonctionnait en appliquant une pression négative à sa sortie avec un répartiteur de flux hors puce en forme de Y en gardant les solutions des canaux « déchets à faible mobilité » et « déchets à haute mobilité » séparés pour éviter un court-circuit partiel de l'appareil. Le potentiel électrique a été appliqué à partir des sorties de solution d'électrolyte en utilisant une solution d'électrolyte en écoulement comme décrit précédemment13. Le débit de la solution d'électrolyte, qui comprenait un traceur fluorescent pour sa visualisation, a été choisi de telle sorte que l'électrolyte atteigne sa sortie plutôt que d'être soutiré dans la chambre de séparation sans l'atteindre (encart en haut à gauche), pourtant il fuirait dans la chambre à une distance contrôlée, laissant suffisamment d'espace pour dévier le faisceau d'échantillon (encart inférieur). Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0072-3
L'appareil avait l'avantage supplémentaire d'effectuer l'ensemble du processus entièrement enraciné pour la séparation électrophorétique en solution libre, permettant aux chercheurs d'obtenir une carte quantitative en quelques minutes, bien plus rapidement que les techniques conventionnelles. Le mélange n'a pas été affecté par le milieu de support, et les chercheurs pourraient étudier les interactions moléculaires faibles et non covalentes.
Sarre et al. a conçu le dispositif à l'aide d'une unité d'électrophorèse quantitative en phase native connectée à une unité de dimensionnement de dispositif de diffusion microfluidique (MDS). La plate-forme combinée a permis des composants de mobilité électrophorétique spécifique (µ
L'équipe de recherche a appliqué le potentiel électrique sur des connecteurs métalliques pour générer une interface métal-fluide à l'extérieur de la puce conformément au prototype de dispositif conçu par la même équipe. Dans ce travail, Sarre et al. a conçu un diviseur de flux en forme de Y et a maintenu les flux séparés jusqu'à ce qu'ils atteignent le diviseur pour éviter un court-circuit partiel. Ils ont calculé le débit de l'électrolyte dans l'appareil pour avoir un effet sur les performances de l'appareil.
(a) La tension appliquée à travers la chambre d'électrophorèse a été ajustée par étapes linéaires pour diriger des fractions spécifiques à l'analyse. (b) Les fractions ont ensuite été dimensionnées par imagerie de l'unité de dimensionnement diffusionnelle constituée de quatre canaux dans lesquels l'étendue de la diffusion des molécules d'analyte dans leur tampon porteur environnant a été surveillée. (c) La taille moyenne des molécules d'analytes dans chacune des fractions a été trouvée en ajustant les profils fluorescents observés pour différents rayons hydrodynamiques (Rh) et en minimisant la moindre erreur quadratique moyenne entre l'ajustement (ligne pointillée rouge) et les données (bleu ligne continue). (d) L'intensité de fluorescence dans la zone d'analyse variait en fonction de la concentration des analytes dans chacune des fractions (en haut) et les tailles des composants dans un mélange binaire de lysozyme et d'albumine de sérum bovin se sont avérées être Rh = 1.9 nm et Rh = 3,6 nm (en bas). (e) Ce mélange binaire n'a pas pu être caractérisé à l'aide de techniques de dimensionnement n'impliquant pas d'étapes de pré-fractionnement, telles que la diffusion dynamique de la lumière (DLS ; ligne pointillée bleu clair). Son dimensionnement a été possible grâce au dispositif décrit dans cet ouvrage (trait continu bleu foncé). Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0072-3 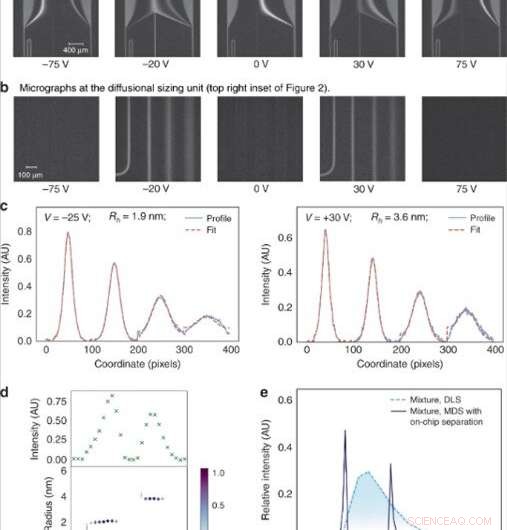
Ils ont imagé la buse à laquelle l'échantillon a rencontré le milieu porteur comme point de référence sur le mouvement des particules. Les scientifiques ont ajusté le canal de dimensionnement diffusionnel ou le débit pour dimensionner avec précision les molécules d'analyte, ordres de grandeur plus ou moins grands. Depuis qu'ils ont conçu la plate-forme de microfluidique en utilisant du poly(diméthylsiloxane) (PDMS), les scientifiques ont éliminé toute autofluorescence dans la configuration avant d'analyser les données d'image.
Ils ont ensuite utilisé l'appareil pour analyser un mélange binaire d'échantillons de protéines; albumine de sérum bovin et lysozyme humain. Pour préserver les états natifs des molécules de protéines, ils ont imagé les échantillons sans étiquette avec un microscope à longueur d'onde UV construit à la maison et quantifié la fluorescence intrinsèque de l'échantillon. Sarre et al. a confirmé la capacité de séparer le mélange en ses composants en appliquant d'abord un ensemble de tensions pour enregistrer les profils fluorescents. Ils ont ensuite enregistré les mobilités électrophorétiques des protéines (µ
En utilisant la plateforme, ils ont rapidement caractérisé des mélanges de molécules nanométriques, où les analytes individuels ont montré des tailles similaires mais des propriétés électrophorétiques diverses. Sur la base de l'histogramme obtenu, l'équipe de recherche a confirmé la présence de deux échantillons distincts. Relativement, dans une approche de séparation conventionnelle hors puce, cette dernière étape nécessitait un fractionnement par transfert d'échantillon d'un outil analytique à un autre via des tubes interconnectés, limitant les performances de l'appareil. La concentration totale de protéines dans l'étude avoisinait 100 µM et les scientifiques ont détecté avec précision la limite de sensibilité à environ 100 nM, par rapport à la fluorescence intrinsèque des fractions protéiques. Pour les composés optiquement non actifs, Sarre et al. suggèrent une stratégie alternative de détection et de caractérisation telle que la détection de masse sèche.
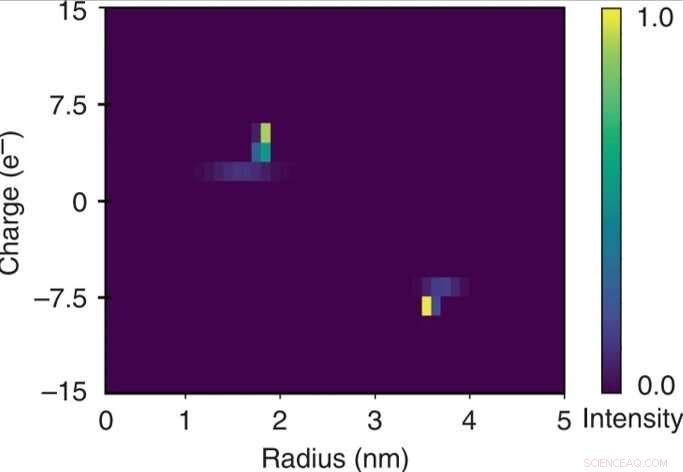
Caractérisation bidimensionnelle rapide d'un mélange d'albumine de sérum bovin et de lysozyme humain. Le caractère quantitatif de l'unité de séparation électrophorétique a permis de relier le potentiel appliqué à la mobilité électrophorétique μel de chacune des fractions. Ces données ont été utilisées en combinaison avec les rayons hydrodynamiques extraits (Rh) pour estimer les charges effectives (q) des molécules dans chacune des fractions et pour construire une carte bidimensionnelle q vs Rh du mélange sur une échelle de temps de quelques minutes en surveiller l'appareil uniquement sur une seule trame d'imagerie. Crédit :Microsystèmes &Nano-ingénierie, doi:10.1038/s41378-019-0072-3
Sarre et al. utilisé la stratégie pour obtenir des cartes caractéristiques bidimensionnelles (2-D) du mélange de protéines comme preuve de concept. Ils ont extrait des informations quantitatives de l'étape de séparation et lié les potentiels appliqués aux mobilités électrophorétiques des espèces pour estimer l'efficacité du dispositif. Ils ont enregistré le courant circulant dans le système pendant le fonctionnement normal et lorsque la chambre de séparation a été court-circuitée pour estimer la résistance électrique totale du dispositif et des électrodes.
Les chercheurs ont calculé la mobilité électrophorétique comme le mouvement d'une particule dans un champ électrique pour chacune des fractions. Sur la base des données expérimentales, la carte caractéristique 2D construite incluait la charge effective (q) et le rayon hydrodynamique (Rh) du mélange. Les unités de charge élémentaires résultantes des protéines spécifiques concordaient avec les valeurs estimées ailleurs. Ils ont obtenu la carte bidimensionnelle complète en ne surveillant qu'une seule trame d'imagerie pour une analyse rapide de la solution.
Le temps analytique du dispositif microfluidique de la séparation au dimensionnement diffusionnel et à l'imagerie était d'environ 14 secondes. Les scientifiques ont construit la carte expérimentale en 2D en utilisant seulement 3 µL d'échantillon sur sept minutes au total, ordres de grandeur plus rapides que l'échelle de temps pour réaliser des gels de protéines 2-D conventionnels. L'équipe de recherche a mené un large éventail d'interactions biomoléculaires, en solution, directement dans des conditions natives qui étaient auparavant difficiles à réaliser en laboratoire.
De cette façon, Kadi L. Saar et ses collègues ont développé un dispositif microfluidique combinant la séparation sur puce avec une analyse directe sur puce pour remplacer les approches micro-échelle conventionnelles existantes. À l'aide de l'appareil, ils ont rapidement analysé un mélange binaire de protéines qui ne pouvaient pas être identifiées en tant que composants individuels via les approches de dimensionnement de solution existantes. Ils ont construit une carte caractéristique 2D du mélange hétérogène sur une échelle de temps rapide pour ouvrir la possibilité de caractérisation des protéines en solution à une résolution temporelle sans précédent par rapport aux techniques biophysiques existantes.
© 2019 Réseau Science X