Le professeur adjoint du MIT, Betar Gallant (à gauche) et l'étudiante diplômée Aliza Khurram développent une nouvelle batterie qui pourrait à la fois capturer le dioxyde de carbone dans les gaz d'échappement des centrales électriques et le convertir en un solide prêt à être éliminé en toute sécurité. Crédit :Stuart Darsch
Réduire le dioxyde de carbone (CO
Une meilleure approche serait de convertir le CO capturé
Bétar Gallant, un professeur adjoint de génie mécanique, et son groupe au MIT se sont donc concentrés sur les réactions électrochimiques non aqueuses (sans eau), en particulier, ceux qui se produisent à l'intérieur du lithium-CO
Recherche sur le lithium-CO
Étant donné l'absence de progrès, Gallant voulait essayer quelque chose de différent. "Nous étions intéressés à essayer d'apporter une nouvelle chimie pour résoudre le problème, " dit-elle. Et en faisant appel aux molécules absorbantes qui capturent si efficacement le CO
Repenser l'amine
La molécule de sorbant utilisée dans le CCS est une amine, un dérivé de l'ammoniac. En CCS, l'échappement est barboté à travers une solution contenant une amine, et l'amine lie chimiquement le CO
L'étudiante diplômée Aliza Khurram se prépare à des expériences en pompant du dioxyde de carbone à travers une cellule électrochimique composée d'électrodes au lithium et au carbone et d'un électrolyte spécialement conçu. Crédit :Stuart Darsch
En CCS, ces dernières étapes nécessitent des températures élevées, qui sont atteints en utilisant une partie de la production électrique de la centrale. Gallant s'est demandé si son équipe pourrait plutôt utiliser des réactions électrochimiques pour séparer le CO
La recherche sur la technologie CSC a permis de bien comprendre le processus de capture du carbone qui se déroule à l'intérieur d'un système CSC. Quand le CO
Dans son schéma, Gallant a proposé d'utiliser l'électrochimie pour séparer le CO
À la fois, les réactions sur l'électrode de carbone devraient favoriser le flux d'électrons lors de la décharge de la batterie, même sans catalyseur métallique. "La décharge de la batterie se produirait spontanément, " Gallant dit. " Et nous casserions l'adduit d'une manière qui nous permet de renouveler notre CO
Un processus de découverte
En 2016, Gallant et étudiante au doctorat en génie mécanique, Aliza Khurram a commencé à explorer cette idée.
Leur premier défi était de développer un nouvel électrolyte. Un lithium-CO
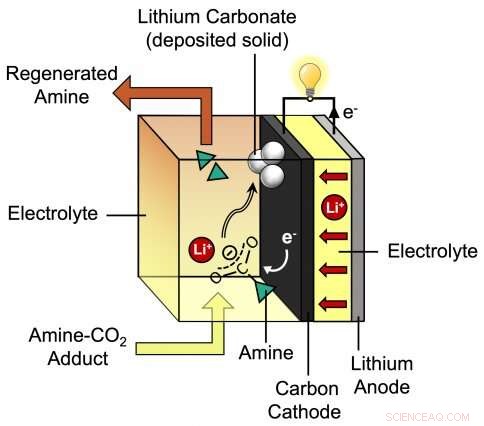
Ce diagramme illustre le processus pendant la décharge de la nouvelle batterie lithium-CO2 développée par le professeur assistant du MIT Betar Gallant et son groupe. La batterie proposée par les chercheurs se compose d'une anode au lithium et d'une cathode en carbone entourée d'un électrolyte spécial qui incorpore des ions lithium (Li+) et une amine. Crédit :Massachusetts Institute of Technology
Ils ont commencé par tester d'éventuels solvants. Ils ont mélangé leur CO
Cependant, pour que tout appareil électrochimique fonctionne, l'électrolyte doit être enrichi d'un sel pour fournir des ions chargés positivement. Parce que c'est une batterie au lithium, les chercheurs ont commencé par ajouter un sel à base de lithium et les résultats expérimentaux ont radicalement changé. Avec la plupart des candidats solvables, l'ajout du sel a instantanément provoqué la formation de précipités solides dans le mélange ou sa viscosité élevée, des résultats qui les ont exclus en tant que solvants viables. La seule exception était le solvant diméthylsulfoxyde, ou DMSO. Même lorsque le sel de lithium était présent, le DMSO pourrait dissoudre l'amine et le CO
"Nous avons découvert que, fortuitement, le sel à base de lithium était important pour permettre à la réaction de se dérouler, " dit Gallant. " Il y a quelque chose à propos de l'ion lithium chargé positivement qui se coordonne chimiquement avec l'amine-CO
Exploration du comportement de la batterie pendant la décharge
Pour examiner le comportement de décharge de leur système, les chercheurs ont mis en place une cellule électrochimique constituée d'une anode de lithium, une cathode en carbone, et leur électrolyte spécial - pour plus de simplicité, déjà chargé en CO
Comme ils l'avaient espéré, leur électrolyte spécial a en fait favorisé la réaction de décharge dans la cellule d'essai. "Avec l'amine incorporée dans l'électrolyte à base de DMSO avec le sel de lithium et le CO
L'étape suivante consistait à confirmer que les réactions séparaient bien l'amine du CO
Cette image au microscope électronique à balayage (MEB) montre la cathode du système lithium-dioxyde de carbone des chercheurs après décharge. L'analyse des structures sphériques confirme qu'elles sont composées de Li2CO3. L'encart montre une image SEM de la cathode de carbone avant la décharge. L'absence des sphères confirme qu'elles se sont formées lors de la décharge. Crédit :Massachusetts Institute of Technology
Dans un essai, ils ont produit des images de la surface cathodique post-réaction à l'aide d'un microscope électronique à balayage (MEB). Immédiatement évidentes étaient des formations sphériques avec une taille caractéristique de 500 nanomètres, régulièrement répartis à la surface de la cathode. Selon Gallant, la structure sphérique observée du produit de décharge était similaire à la forme de Li
D'autres analyses ont confirmé que le solide déposé sur la cathode était Li
"L'amine peut être considérée comme activant efficacement la réactivité du CO
Directions futures
Gallant souligne que le travail à ce jour ne représente qu'une étude de validation de principe. "Il y a encore beaucoup de science fondamentale à comprendre, " elle dit, avant que les chercheurs puissent optimiser leur système.
Elle et son équipe continuent d'étudier les réactions chimiques qui se produisent dans l'électrolyte ainsi que la composition chimique de l'adduit qui se forme, « l'état réactif » sur lequel l'électrochimie ultérieure est effectuée. Ils examinent également le rôle détaillé de la composition du sel.
En outre, il y a des préoccupations pratiques à prendre en compte lorsqu'ils réfléchissent à la conception de l'appareil. Un problème persistant est que le dépôt solide obstrue rapidement la cathode de carbone, donc d'autres réactions chimiques ne peuvent pas se produire. Dans une configuration qu'ils étudient - une conception de batterie rechargeable - la cathode est découverte pendant chaque cycle de décharge-charge. Les réactions lors de la décharge déposent le solide Li
Les chercheurs utilisent cette configuration pour tester la capacité de stockage et la tension de décharge de leurs batteries. Crédit :Stuart Darsch
La deuxième configuration que les chercheurs étudient, une configuration à décharge uniquement, résout ce problème en ne permettant jamais au CO gazeux
Gallant et son équipe travaillent maintenant sur les deux configurations de leur système. "Nous ne savons pas encore ce qui est le mieux pour les applications, " dit-elle. Alors qu'elle croit que le lithium-CO pratique
L'un des objectifs est de remplacer le lithium par un métal moins coûteux et plus abondant en terre, comme le sodium ou le calcium. Avec un financement de démarrage de la MIT Energy Initiative, l'équipe a déjà commencé à étudier un système à base de calcium, un matériau qui n'est pas encore bien développé pour les applications de batterie. Si le calcium-CO
En attendant, Gallant et ses collègues sont heureux d'avoir trouvé ce qui semble être une nouvelle classe de réactions pour capturer et séquestrer le CO
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.