Une illustration de la réaction chimique développée dans l'étude. Crédit :J. Waser/B. Fierz (EPFL)
Comprendre la structure et le métabolisme des cellules et des organismes vivants est essentiel pour le développement de nouveaux médicaments et diagnostics. La disponibilité d'outils chimiques permettant aux scientifiques d'éditer des biomolécules, comme les protéines, avec une résolution au niveau de l'atome ont grandement contribué aux progrès de la biologie chimique.
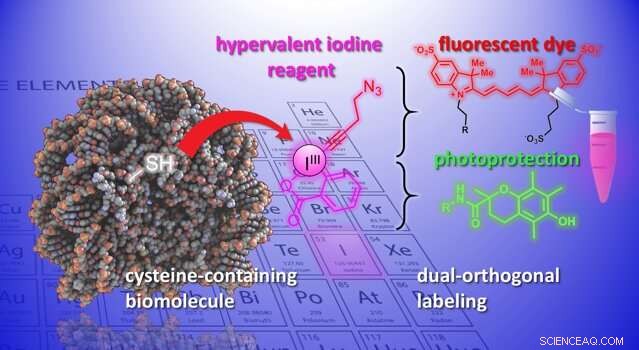
Les protéines sont des macromolécules construites à partir d'un ensemble de vingt acides aminés chimiquement différents. Une approche clé pour modifier les protéines consiste à réagir avec l'atome de soufre dans l'acide aminé cystéine. Cependant, les méthodes actuelles sont encore problématiques en termes d'efficacité, sélectivité, et la stabilité du produit final (le "produit d'addition").
Maintenant, les laboratoires de Jérôme Waser et Beat Fierz de l'Institut des sciences et de l'ingénierie chimiques de l'EPFL ont développé une nouvelle méthode pour modifier les cystéines sur les peptides et les protéines. La méthode utilise un groupe de molécules organiques hautement réactives, les éthynylbenziodoxolones (EBX). Ce qui rend les EBX très réactifs, c'est qu'ils contiennent un atome d'iode lié à trois groupes substituants. Cette situation non naturelle conduit à une forte réactivité de ces réactifs dits "à l'iode hypervalent".
Pour la première fois, les chercheurs ont pu générer un simple adduit biomolécule-EBX tout en conservant leur groupe iode réactif dans la molécule finale. La réaction peut être facilement réalisée par un non-spécialiste dans des conditions physiologiques standard.
Le produit final sont des chimères de réactifs à l'iode hypervalent protéine qui peuvent agir comme des points de fixation doubles pour deux nouveaux groupes chimiques, ouvrant de nouvelles perspectives pour l'étude des processus biologiques.
"Une nouvelle fonctionnalité peut être introduite via 'click-chemistry, ' une réaction bien établie en biologie chimique, " dit Waser. " À l'aide d'un catalyseur au palladium, une autre modification sélective peut être obtenue au niveau de l'atome d'iode réactif - ce que nous appellerions une fonctionnalité « biorthogonale », car il n'existe pas dans la nature. » L'introduction de ces groupes réactifs exotiques dans des biomolécules est actuellement l'un des outils les plus importants de la biologie chimique, car il permet l'étude des processus biologiques sans interférer avec eux.
Les scientifiques ont démontré le potentiel de la méthode en introduisant un ensemble diversifié de groupes chimiques dans des biomolécules. Par exemple, les scientifiques ont utilisé la double poignée pour attacher simultanément un colorant fluorescent et un groupe photoprotecteur dans un neuropeptide. Leur association améliore la photostabilité du colorant, et permet une haute résolution, imagerie moléculaire unique des interactions moléculaires.
Au-delà des peptides, ils ont encore modifié de petites protéines, et même de grands complexes protéine-ADN, ce qu'on appelle les nucléosomes. Comme les nucléosomes organisent le génome, les marquer avec des colorants fluorescents peut aider à les suivre pour déchiffrer comment la nature régule l'expression des gènes.
"Ce que nous avons développé ici, c'est une nouvelle méthode de modification des protéines basée sur des études fondamentales de réactivité chimique, " dit Fierz. " Nous l'avons déjà utilisé pour modifier des histones, et réalisé des expériences de fluorescence sur des cellules vivantes. Avec ces exemples, nous avons jeté les bases d'une meilleure compréhension des processus biologiques."
L'étude est publiée dans Chimie aujourd'hui.