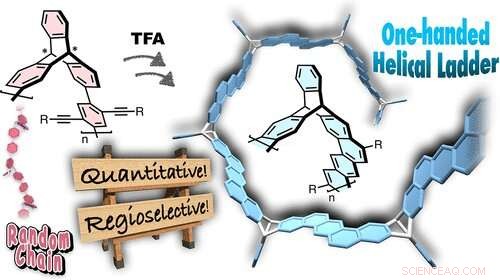
Rapport :Une synthèse efficace de molécules et de polymères de type échelle optiquement actifs par cyclisation intramoléculaire de triptycènes chiraux contenant des unités bis[2-(4-alkoxyphényl)éthynyl]phénylène. Les réactions de cyclisation induites par les électrophiles sont dirigées loin des atomes de carbone tête de pont du triptycène par des facteurs stériques, produisant ainsi des unités d'échelle torsadées à une main sans aucun sous-produit détectable. De plus, la nature quantitative et régiosélective de cette cyclisation intramoléculaire nous a permis de synthétiser des polymères en échelle optiquement actifs avec une géométrie hélicoïdale à une main bien définie dans laquelle homoconjugué dibenzo[a, les unités h]anthracène sont disposées en hélice le long de la chaîne principale. Cette voie de synthèse permet la construction d'une variété d'architectures en échelle hélicoïdale à l'échelle nanométrique et fournit une entrée dans de nouveaux matériaux chiroptiques.
Des chercheurs de l'Université de Kanazawa ont synthétisé des polymères en échelle hélicoïdale avec une unité de répétition cyclique bien définie et une géométrie hélicoïdale à une main, comme ils l'ont signalé dans le Journal de l'American Chemical Society .
Les polymères en échelle (molécules constituées d'anneaux adjacents partageant deux atomes ou plus) sont difficiles à synthétiser, car ils nécessitent une très grande sélectivité, des réactions quantitatives pour éviter la formation de structures ramifiées ou d'interruptions de la séquence cyclique dans la chaîne polymère. De plus, la plupart des stratégies existantes pour la synthèse de polymères échelle souffrent de sévères limitations en termes de sélectivité et de quantitativité. Un autre type important de molécules sont les molécules à structure hélicoïdale (telles que l'ADN et les protéines), qui jouent un rôle important dans la reconnaissance moléculaire et la catalyse. Ainsi, la fabrication de molécules possédant à la fois une structure en échelle et une structure hélicoïdale pourrait ouvrir de nouvelles applications de matériaux polymères.
Tomoyuki Ikai, Timothy M. Swager et ses collègues d'une collaboration internationale ont commencé à partir du triptycène, un hydrocarbure aromatique qui est une molécule achirale, mais à partir desquels des dérivés chiraux peuvent être obtenus en introduisant des substituants dans les cycles benzéniques de manière asymétrique. Les triptycènes optiquement actifs ont des utilisations pratiques en tant que matériaux chiraux, par exemple pour la séparation chirale et les matériaux luminescents polarisés circulairement. Les chercheurs ont ensuite utilisé les triptycènes chiraux comme cadre pour former efficacement des polymères en échelle hélicoïdale à une main en utilisant une substitution aromatique électrophile. La répulsion stérique dans le système a entraîné la formation d'unités d'échelles torsadées à une main. Les réactions étaient quantitatives et régiosélectives (c'est-à-dire il existe une direction préférée de liaison chimique), qui a permis la synthèse de polymères en échelle optiquement actifs avec une géométrie hélicoïdale bien définie. Aucun sous-produit n'a été détecté.
Plusieurs techniques, y compris les techniques de spectroscopie et de microscopie, ont été utilisés pour caractériser les produits de réaction lors de la synthèse, et des simulations de dynamique moléculaire ont été utilisées pour comprendre la structure des molécules résultantes, confirmant la géométrie de l'échelle hélicoïdale à droite. Les chercheurs ont également mesuré l'activité optique des molécules.
La nouvelle voie de synthèse annoncée ouvrira la synthèse d'architectures en échelle hélicoïdale nanométrique et de matériaux chiraux optiquement actifs. "Nous pensons que ces polymères en échelle, qui peuvent entrer dans une nouvelle catégorie de polymères hélicoïdaux, représentent une classe prometteuse de matériaux avancés à utiliser comme nanocanaux pour le transport moléculaire/ionique, électronique organique, champs de réaction spécifiques, et des hôtes fonctionnels grâce à une modification supplémentaire de l'épine dorsale et des unités pendantes, " ont commenté les auteurs dans le journal.
Chiralité
Un système chiral est un système asymétrique qui ne peut pas être superposé à son image miroir (le mot vient du grec pour les mains, parce que les mains sont un bon exemple de système chiral). La plupart des biomolécules et molécules utilisées dans les composés pharmaceutiques sont chirales. Deux molécules de chiralité opposée ont la même composition et la même structure, mais des formes de miroir, et ils ont des propriétés différentes lorsqu'ils interagissent avec d'autres molécules chirales.
Substitution aromatique électrophile
La substitution aromatique électrophile est une réaction organique dans laquelle un atome attaché à un système aromatique est remplacé par un atome qui est un accepteur d'électrons (un électrophile). C'est une classe importante de réactions, impliquant généralement un cycle benzénique.
Répulsion stérique
La répulsion stérique est un effet qui résulte des forces répulsives qui se déclenchent lorsque les atomes se rapprochent trop les uns des autres, de sorte que leurs nuages d'électrons se chevauchent.