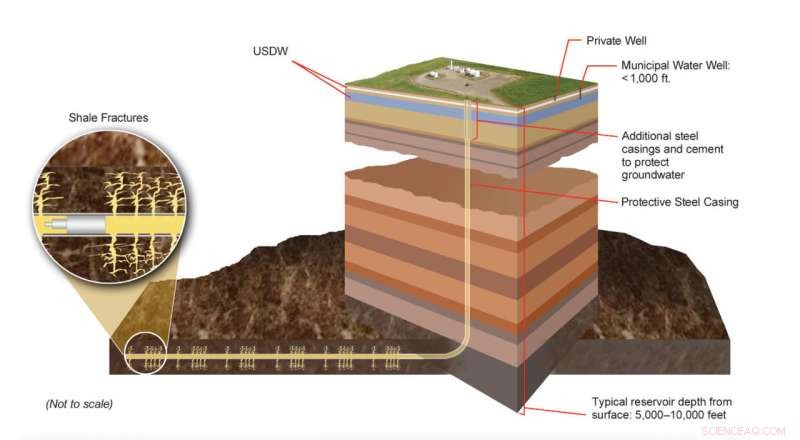
Des portions productibles de formations de gaz de schiste sont situées à plusieurs milliers de pieds sous la surface terrestre, bien en dessous des sources souterraines d'eau potable (USDW). La technologie moderne de fracturation hydraulique implique des processus d'ingénierie sophistiqués conçus pour créer des réseaux de fractures distincts dans des couches rocheuses spécifiques. Des experts surveillent en permanence ces processus pour s'assurer qu'ils sont conformes aux Etat, et les lois et règlements fédéraux. Crédit :DOE des États-Unis
Et si un important gaz à effet de serre piégeant la chaleur pouvait être consommé pour produire un produit chimique précieux qui est rare ? Les chimistes du laboratoire national de Brookhaven du département américain de l'Énergie (DOE) ont identifié un catalyseur, une substance qui accélère une réaction chimique, qui pourrait être capable de faire exactement cela. Ce catalyseur « bimétallique », en fer et nickel, entraîne la réaction du gaz à effet de serre dioxyde de carbone et du gaz propane riche en énergie pour produire du propylène. Le propylène est un bloc de construction chimique utilisé dans la fabrication de nombreux articles de tous les jours, y compris les piles, Pièces automobiles, et les vêtements et autres textiles.
L'écart de production de propylène
Historiquement, le propylène est un sous-produit du vapocraquage - un processus dans lequel une matière première (matière première) est mélangée à de la vapeur et chauffée à environ 1 500 degrés Fahrenheit à l'intérieur de fours massifs qui « cassent » les liaisons moléculaires - pour produire de l'éthylène, le précurseur de la plupart des plastiques du monde. Cependant, le propylène n'est plus coproduit dans les quantités nécessaires pour répondre à la demande. Au cours de la dernière décennie, gaz de schiste, ou du gaz naturel de roches sédimentaires à grains fins, est devenu très bon marché aux États-Unis en raison des progrès technologiques de la fracturation hydraulique. Le gaz de schiste se compose principalement de méthane, mais contient également des fractions d'éthane et de propane. L'industrie a profité de cette abondance d'éthane à faible coût dans les matières premières pour la production d'éthylène, mais au détriment de la production de propylène.
« La quantité de propylène coproduit dépend du type de matière première utilisée, et le vapocraquage de l'éthane est hautement sélectif vis-à-vis de l'éthylène, " dit Jingguang Chen, qui détient des nominations conjointes en tant que chimiste principal au Brookhaven Lab et en tant que professeur Thayer Lindsley de génie chimique à l'Université de Columbia. « Des technologies qui ciblent spécifiquement la production de propylène sont nécessaires pour combler le vide de ce produit chimique important. »
Une des technologies existantes est la déshydrogénation du propane, dans lequel deux atomes d'hydrogène sont retirés du propane (C3H8) pour produire du propylène (C3H6). Mais ce procédé est très énergivore en raison des températures élevées nécessaires pour obtenir des rendements en propylène importants. Bien que l'ajout d'oxygène à l'alimentation en propane diminue la quantité d'énergie requise, en présence d'un excès d'oxygène, le propane brûle pour former de l'eau et du dioxyde de carbone.
Une nouvelle voie de production de propylène
Dans cette étude, les scientifiques ont trouvé une approche plus respectueuse de l'environnement et de l'énergie en introduisant du dioxyde de carbone comme réactif, au lieu d'un produit.
"Le dioxyde de carbone sert d'oxydant, réagir avec du propane pour produire du propylène, l'eau, et monoxyde de carbone, " a déclaré Elaine Gomez, un doctorat candidat en génie chimique à l'Université de Columbia et membre du groupe de recherche de Chen. Gomez est le premier auteur d'une publication récemment publiée Communication Nature article décrivant le travail.
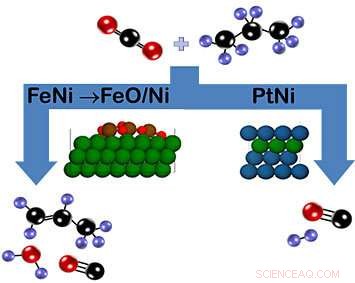
Comme le montre le schéma, le dioxyde de carbone et le propane peuvent réagir sur le catalyseur fer-nickel (FeNi) pour former du propylène (à gauche) ou sur le catalyseur platine-nickel (PtNi) pour former du gaz de synthèse (à droite). Dans le cas de FeNi, une couche d'oxyde de FeO/Ni qui se forme au cours de la réaction favorise la rupture de la liaison C-H. Par contre, le catalyseur PtNi n'a pas de phase oxyde. Clé de couleur :carbone =noir, oxygène =rouge, hydrogène =violet, nickel =vert, fer =marron, platine =bleu). Crédit :Laboratoire national de Brookhaven
Pour que cette réaction se déroule, les scientifiques ont dû concevoir un catalyseur qui pourrait remplir deux fonctions :activer le dioxyde de carbone (une molécule très stable) et rompre une liaison carbone-hydrogène (C-H).
"La base de notre catalyseur est la cérine, ou oxyde de cérium, qui active le dioxyde de carbone en échangeant librement de l'oxygène, " a expliqué Gomez. " En plus de ce soutien, on ajoute les métaux fer et nickel, qui peut rompre la liaison C-H."
Sur la base de travaux antérieurs menés par le groupe de Chen, l'équipe avait une intuition sur le catalyseur à choisir. En utilisant les ressources informatiques du Brookhaven Lab's Center for Functional Nanomaterials et du National Energy Research Scientific Computing Center de Lawrence Berkeley (tous deux du DOE Office of Science User Facilities), Le chimiste de Brookhaven Ping Liu et l'associé de recherche Shyam Kattel ont calculé la quantité d'énergie requise pour que les différentes étapes de la réaction catalytique se déroulent. Leurs calculs étaient basés sur des études de spectroscopie d'absorption des rayons X que Gomez et les co-auteurs Bingham Yan et Siyu Yao du département de chimie de Brookhaven ont effectuées à la source lumineuse de rayonnement synchrotron de Stanford au laboratoire national de l'accélérateur SLAC et à la source avancée de photons du laboratoire national d'Argonne (également DOE Office of Science User Facilities) pour identifier la structure et la composition des sites actifs du catalyseur dans les conditions de réaction. Les spectres résultants ont révélé que la surface du catalyseur fer-nickel est oxydée pendant la réaction, et les calculs ont montré que cette interface oxyde de fer-nickel favorise la rupture de la liaison C-H.
"Une méthode de calcul appelée théorie de la fonctionnelle de la densité [DFT] nous permet de calculer la thermodynamique et la cinétique de la voie de réaction avec un catalyseur donné pour déterminer si la rupture de la liaison C-H est énergétiquement favorable, " a déclaré Kattel. " DFT prédit que le catalyseur à base de fer et de nickel est un bon candidat. "
Gomez a confirmé cette prédiction par des études de réacteur à flux, dans lequel les différents gaz réactifs sont alimentés à partir de réservoirs de stockage dans une seule ligne reliée à un réacteur en tube de verre en forme de U. Le mélange gazeux s'écoule dans une extrémité du tube et réagit avec le catalyseur en poudre (à la température où le catalyseur est actif - dans ce cas, environ 1000 degrés Fahrenheit) emballé dans l'autre extrémité du tube. Au fur et à mesure que les produits émergent, une technique de séparation appelée chromatographie en phase gazeuse peut être utilisée pour identifier le type et les quantités de produits chimiques présents. En comparant les quantités de réactifs consommés et les produits fabriqués, les scientifiques peuvent déterminer la sélectivité du catalyseur vis-à-vis du produit souhaité. Dans cette expérience, la sélectivité était supérieure à 50 pour cent pour la conversion du propane en propylène.
En utilisant le même support en cérine mais en remplaçant le fer par du platine, les scientifiques ont promu une voie de réaction différente dans laquelle les liaisons carbone-carbone sont rompues pour produire du monoxyde de carbone et de l'hydrogène, une combinaison connue sous le nom de gaz de synthèse (syngas), un intermédiaire pour la production d'ammoniac, méthanol, et d'autres produits chimiques.
"Les deux catalyseurs sont actifs à la même température, mais en ajustant leur composition chimique, on peut piloter la réaction pour produire du propylène ou du gaz de synthèse, " dit Chen.
« Nous prévoyons d'utiliser notre compréhension approfondie actuelle du mécanisme de réaction pour améliorer encore la conversion du propane en propylène, " a déclaré Liu. " Cette compréhension permet le criblage rationnel des catalyseurs à un niveau théorique, et les candidats prometteurs seront synthétisés et testés expérimentalement."
"Nous espérons que l'industrie et le monde universitaire considéreront notre nouvelle voie, qui consomme un gaz à effet de serre et nécessite moins d'énergie que les méthodes traditionnelles de production de propylène, " a déclaré Gomez. " Traduire notre découverte en une technologie commercialisée pourrait aider à répondre à la demande mondiale pour ce produit chimique de grande valeur. "