
Expérience de la lumière du soleil. Les réactions peuvent être effectuées en utilisant la lumière du soleil dans un simple flacon en verre. Crédit :J. Waser/EPFL
La découverte de nouvelles cibles biologiques est un élément essentiel de notre combat continu contre les maladies. Au cours des années, les scientifiques ont fait des progrès impressionnants vers la compréhension des systèmes biologiques, identifier constamment de nouvelles cibles. La diversité structurelle de ces cibles nécessite une large gamme d'agents thérapeutiques différents.
« Les petites molécules synthétiques restent des acteurs incontournables, mais les biomolécules telles que les peptides, les protéines et les oligonucléotides sont devenus un domaine de recherche important, " dit le professeur Jérôme Waser, directeur du Laboratoire de Catalyse et de Synthèse Organique de l'EPFL. Les peptides sont particulièrement intéressants, avec environ 140 évalués dans des essais cliniques en 2015. Cependant, les peptides ne sont souvent pas stables dans le sang et ne peuvent pas bien pénétrer les cellules, les deux diminuent leur utilisation potentielle en tant que drogues.
Une solution pour surmonter ces difficultés est de modifier chimiquement la structure naturelle des peptides, un processus appelé "fonctionnalisation". En chimie, une molécule est « fonctionnalisée » en lui ajoutant des groupements chimiques, le dotant ainsi de nouvelles fonctions, capacités, ou des propriétés, comme une stabilité accrue dans le corps humain. Cependant, la fonctionnalisation des peptides est difficile, en raison de leur structure complexe.
"La raison principale est le manque de sélectivité lorsque vous essayez de modifier un peptide :il contient de nombreuses positions qui réagissent avec des produits chimiques, résultant en des mélanges inutiles, " explique Waser. " Par conséquent, Les méthodes permettant la fonctionnalisation sélective d'une position unique dans les peptides sont activement recherchées pour accéder à des médicaments à base de peptides plus efficaces et stables.
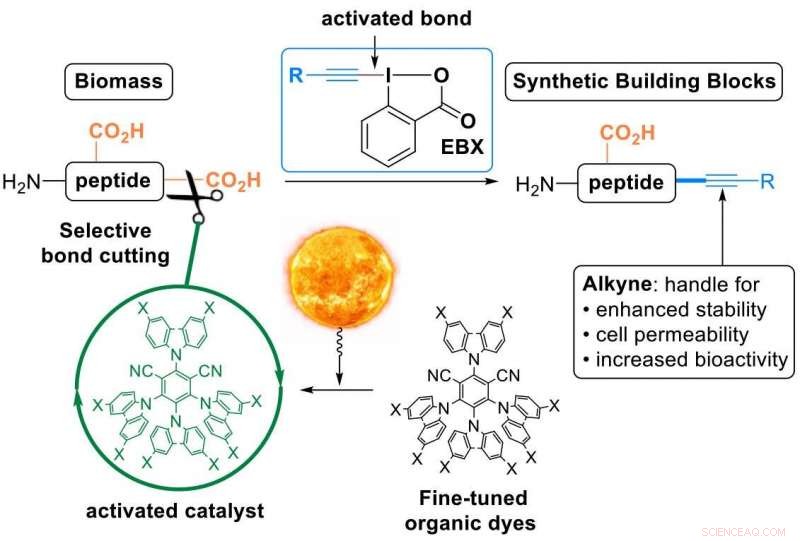
C'est ce que le laboratoire de Waser a maintenant réalisé, utilisant les "réactifs EBX" - une classe de composés organiques très réactifs développés par le groupe et désormais disponibles dans le commerce. En utilisant ces réactifs, les chercheurs ont converti l'acide carboxylique C-terminal des peptides en une triple liaison carbone-carbone – un alcyne (dans le jargon chimique une « alcynylation décarboxylative »). Le fragment alcyne est un groupe fonctionnel très précieux qui peut être utilisé pour modifier davantage les peptides. Il a été largement utilisé dans la découverte de médicaments, sciences des matériaux et biologie chimique.
Faire le pont entre le monde naturel et le monde synthétique en une seule étape :Modification de peptides à l'aide de colorants organiques excités par la lumière visible et les réactifs EBX. Crédit :J. Waser/EPFL
Les peptides ne réagissent pas spontanément avec les réactifs EBX, les scientifiques ont donc dû utiliser un catalyseur. Pour l'activer, les chercheurs se sont tournés vers la lumière ou, en termes plus techniques, « catalyse photoredox » :la lumière visible est absorbée par le catalyseur, qui active ensuite sélectivement une liaison dans les molécules en réaction. "L'utilisation de la lumière comme source d'énergie renouvelable pour effectuer des réactions organiques permet une résolution temporelle et spatiale avec des conditions de réaction très douces, " dit Waser.
Les chercheurs ont fait deux innovations :d'abord, ils ont conçu de nouveaux colorants organiques affinés comme catalyseurs photorédox. Ceci était important car les réactions à médiation lumineuse sont généralement basées sur de rares, catalyseurs de métaux de transition toxiques et coûteux.
Seconde, les chercheurs ont réalisé cette première « alcynylation décarboxylative » sur des peptides natifs. Il s'agit d'une transformation en une étape particulièrement attrayante d'un composé naturel en un dérivé synthétique car elle offre une plate-forme pour modifier les propriétés physiques et chimiques du peptide grâce à un seul, manipulation facile à réaliser (tous les "ingrédients" n'ont qu'à être mélangés et laissés reposer à la lumière naturelle).
La méthode peut être utilisée avec presque tous les acides aminés présents sur les peptides, tout en maintenant une sélectivité complète envers la position C-terminale sur les chaînes latérales peptidiques.
Avec leur nouvelle méthode, les scientifiques ont également pu obtenir des dérivés du précieux peptide bioactif GRGDNP qui empêche les cellules de se fixer à la fibronectine, un processus important dans la vasodilatation des vaisseaux sanguins, ce qui pourrait être très utile dans l'étude des maladies cardiovasculaires.