Tableau périodique des éléments pouvant présenter une métallophilie. Crédit :L'Université de Hong Kong
Une équipe de recherche dirigée par le professeur Chi-Ming Che et le Dr Jun Yang, de la Division de la recherche en chimie et du Département de chimie de la Faculté des sciences de l'Université de Hong Kong, a résolu un problème fondamental de longue date dans le domaine de l'interaction métal-métal en coque fermée. Ce travail a été publié dans la revue Actes de l'Académie nationale des sciences (PNAS) .
Interaction métal-métal en coque fermée, également connu sous le nom de métallophilie, a un impact énorme dans divers domaines de la chimie, comme la chimie supramoléculaire et la chimie organométallique. Les premiers rapports sur la métallophilie remontent aux années 1970. De nombreux chimistes théoriciens de premier plan du monde entier ont apporté des contributions dans le domaine, comme Roald Hoffmann (1981 lauréat du prix Nobel de chimie), Pekka Pyykkô, etc. La métallophilie est importante dans la fabrication d'auto-assemblages par des complexes de métaux de transition, qui a démontré des applications profondes dans les semi-conducteurs organiques, matériaux de biodétection et optoélectroniques fonctionnels.
Aller au-delà des idées reçues
Le terme « métallophilie » est originaire d'Europe et a été largement utilisé par les chimistes comme principe directeur dans les études de conception moléculaire et pour rationaliser les propriétés spectroscopiques des complexes de métaux de transition. Jusqu'à maintenant, le consensus général de la métallophilie dans la communauté universitaire est « attrayant, " qui a été conçu pour provenir de l'hybridation orbitale et/ou de l'effet relativiste d'un atome de métal lourd, comme l'or ou le platine (métal de 3e rangée dans le tableau élémentaire). Avec le professeur Che et le Dr Yang, Le boursier postdoctoral Dr Qingyun Wan et ses collègues ont remis en question la sagesse conventionnelle des chimistes de coordination, concluant que la métallophilie n'est pas une interaction attractive dans un complexe organométallique, mais est en fait de nature répulsive en raison de la forte répulsion de M-M' Pauli.
Ils ont effectué une recherche théorique et expérimentale combinée sur la métallophilie et ont observé une forte répulsion M-M' Pauli dans des complexes organométalliques ayant des configurations électroniques à coque fermée, qui fournira une nouvelle perspective théorique sur la possibilité de fabriquer de nouveaux matériaux supramoléculaires avec des complexes de métaux de transition peu coûteux et abondants en terre, comme celui du palladium ou de l'argent ou du nickel (métaux de 1er ou 2e rang dans le tableau élémentaire). C'est également une réalisation cruciale dans la compréhension fondamentale des interactions intermoléculaires faibles.
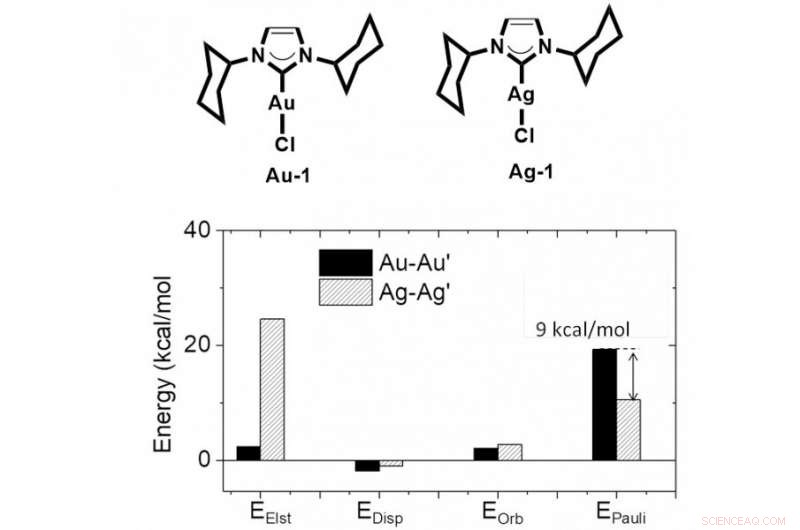
Structure chimique du complexe Au (Élément Or) et Ag (Élément Argent), et les résultats des calculs montrent une répulsion Au-Au Pauli plus forte que la répulsion Ag-Ag Pauli. Crédit :L'Université de Hong Kong
Contexte et réalisation
Dans le micromonde des petites molécules, il existe de nombreux types d'interactions. La métallophilie décrit l'interaction entre les atomes métalliques comme ayant des configurations électroniques à coque fermée. Au début des années 1970, les chimistes ont observé un phénomène intéressant selon lequel deux atomes métalliques à coque fermée pouvaient former une courte distance métal-métal. Une "attraction" spéciale a été proposée pour exister entre deux atomes de métal, poussant deux atomes de métal qui se rapprochent. De nombreux modèles théoriques ont été évoqués pour rendre compte d'un tel attachement, comme le modèle d'hybridation orbitale ou l'effet relativiste du métal lourd. Cependant, ces modèles théoriques sont en conflit avec certaines observations expérimentales, comme la distance Ag-Ag relativement plus courte dans les complexes Ag par rapport à la distance Au-Au dans les analogues Au. Ainsi, ce problème est resté longtemps controversé et a toujours tourmenté les chimistes inorganiques et théoriques.
Les chercheurs de HKU ont utilisé des méthodes de calcul de haut niveau et des techniques expérimentales pour étudier un problème aussi difficile, et a prouvé que la métallophilie est de nature répulsive en raison de la forte répulsion de M-M' Pauli. Ils ont conclu que l'hybridation orbitale et l'effet relativiste renforceraient la répulsion de Pauli métal-métal lors de la formation d'un contact métal-métal étroit. La dispersion intermoléculaire et l'interaction électrostatique contrebalanceront la répulsion métal-métal, conduisant à une courte distance métal-métal. Ce modèle théorique pourrait bien expliquer pourquoi la distance Ag-Ag est plus courte que la distance Au-Au, en raison de la répulsion Ag-Ag Pauli plus faible qui est induite par moins d'hybridation orbitale dans le complexe Ag.
Par une estimation prudente, il y en avait plus de 5, 000 articles publiés dans la littérature sur la « métallophilie attractive ». L'énoncé de « métallophilie répulsive » est proposé pour la première fois par l'équipe de recherche dans sa récente publication PNAS. Ce travail a également été reconnu par le professeur Harry Gray à Caltech, qui a reçu le prix Wolf de chimie en 2004, l'un des prix les plus honorables dans le domaine.