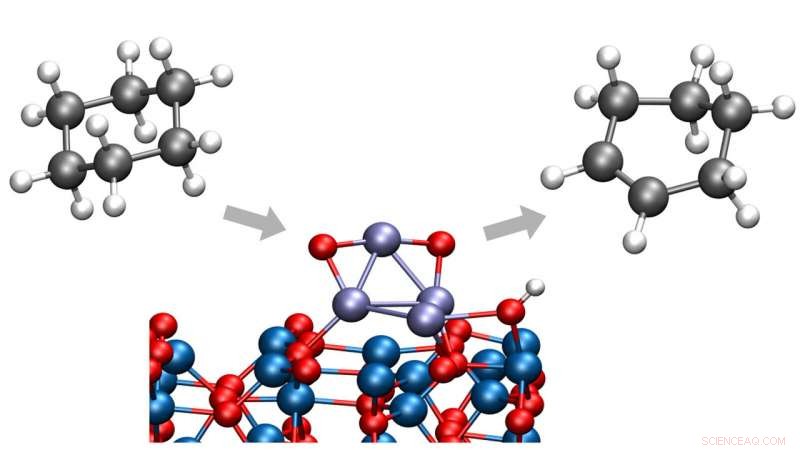
Les chimistes d'Argonne ont identifié un moyen de convertir le cyclohexane en cyclohexène ou cyclohexadiène, deux produits chimiques importants dans un large éventail de procédés industriels. Le nouveau procédé se déroule à basse température, éliminer la création de sous-produits indésirables. Crédit :Laboratoire National d'Argonne
Les chimistes consacrent beaucoup de temps et d'énergie à essayer de déclencher ou d'accélérer des réactions chimiques, mais il peut parfois être tout aussi important de les arrêter avant qu'elles n'aillent trop loin.
Dans une étude récente du Laboratoire national d'Argonne du Département de l'énergie des États-Unis (DOE), les chimistes ont identifié un moyen de convertir le cyclohexane en cyclohexène ou cyclohexadiène, produits chimiques importants dans un large éventail de procédés industriels. Surtout, ce processus se déroule à basse température, éliminer la création de dioxyde de carbone qui aurait résulté d'une rupture indésirable des liaisons carbone-carbone.
Le cyclohexane est une molécule de départ importante dans un large éventail de réactions chimiques, selon le chimiste d'Argonne Stefan Vajda, maintenant à l'Institut de chimie physique J. Heyrovský à Prague. Cependant, sans catalyseur approprié pour amorcer la réaction, la conversion du cyclohexane en produits utiles nécessite généralement des températures élevées générées par la dépense d'une grande quantité d'énergie, et le procédé peut également souffrir d'une mauvaise sélectivité.
Dans l'étude, Vajda et Argonne chimiste Larry Curtiss et leur équipe internationale de collaborateurs ont examiné un type de réaction appelé déshydrogénation oxydative, dans lequel les molécules d'hydrogène sont extraites d'une molécule plus grosse. En coupant un nombre limité de liaisons hydrogène-carbone, la réaction peut produire du cyclohexène et du cyclohexadiène avant la combustion en dioxyde de carbone.
Les travaux ont amélioré les études précédentes de l'équipe d'Argonne sur la déshydrogénation du cyclohexane et du cyclohexène en introduisant deux composants clés :un catalyseur d'oxyde de cobalt de taille inférieure au nanomètre sur un support d'oxyde d'aluminium et un environnement d'oxygène contrôlé.
Les chercheurs ont utilisé des techniques de diffusion des rayons X à la source avancée de photons (APS) d'Argonne, une installation utilisateur du DOE Office of Science, de suivre en temps réel la nature et la stabilité des catalyseurs lors des tests catalytiques des clusters. Ils ont découvert que les clusters effectuaient une déshydrogénation partielle du cyclohexane à des températures d'environ 100 degrés Celsius, bien inférieures à celles observées précédemment pour ce type de réaction, et les amas ont conservé leur nature oxydée et leur stabilité à des températures de réaction allant jusqu'à 300°C.
« Le fait que nous puissions effectuer cette conversion à des températures plus basses protège les produits de déshydrogénation intermédiaires, le cyclohexène et le cyclohexadiène, d'être davantage convertis en produits indésirables, " dit Vajda.
Vajda et Curtiss ont noté que le catalyseur hautement sélectif a une longue durée de vie et n'est pas empoisonné ou dégradé par la réaction. Dans l'étude théorique et expérimentale de la taille du catalyseur, les chercheurs ont découvert que les amas de taille quatre et vingt-sept atomes étaient à peu près aussi efficaces pour effectuer la réaction. "Il semble que tant que le catalyseur a une taille inférieure à environ un nanomètre, cette composition fonctionne bien - un facteur important pour la mise à l'échelle potentielle de cette classe de catalyseurs par des catalyseurs plus traditionnels, bien que moins sélectif selon la taille, voies de synthèse », a déclaré Vajda.
Pour mieux comprendre les mécanismes de base derrière l'activité et la sélectivité des catalyseurs au cobalt, les chercheurs ont utilisé des calculs de la théorie fonctionnelle de la densité pour modéliser les voies de réaction. « Les excellentes performances des clusters de cobalt s'expliquent par des calculs théoriques, qui révèlent des atomes de cobalt très actifs dans les amas et montrent que le caractère oxydé des amas provoque la formation à basse température du produit, " expliqua Curtiss.