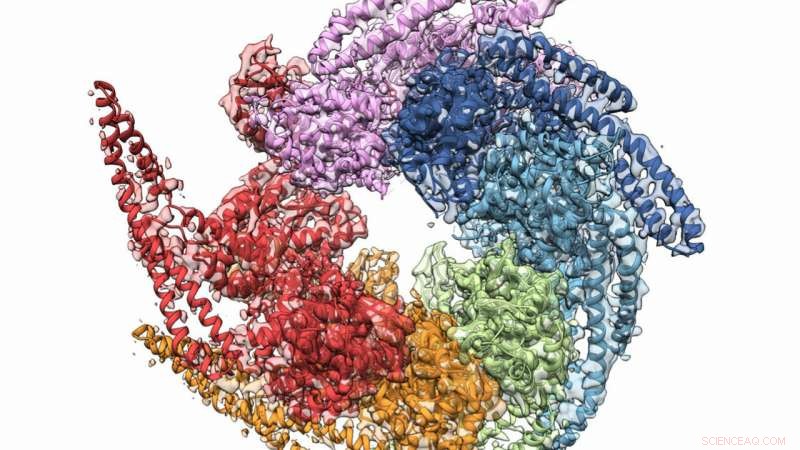
Les structures combinées de microscopie cristalline et cryoélectronique de Hsp104 se désagrègent du champignon Calcarisporiella thermophila . Crédit :Grigore Pintilie / Université de Stanford
Les techniques de microscopie à rayons X et électronique aident à dévoiler l'histoire des chaperons protéiques.
Une combinaison de cristallographie aux rayons X et de cryomicroscopie électronique (cryo-EM) a contribué à un effort de collaboration pour obtenir la structure à la plus haute résolution de la protéine fongique Hsp104, qui peuvent servir à entraver la formation de certaines maladies dégénératives. L'équipe, dont les membres comprenaient des chercheurs du Laboratoire national d'Argonne du Département de l'énergie des États-Unis (DOE), a également vérifié une structure hélicoïdale pour les hexamères formés de protéines, autrefois cru plat. Les résultats ont été publiés en ligne dans le 27 décembre numéro 2018 de Structure .
Hsp104 est une protéine hexamérique AAA+ connue sous le nom de chaperon, qui aide dans les processus naturels de repliement des protéines pour le bon fonctionnement des cellules. Plus important, peut-être, cette classe d'hexamères peut réparer les protéines mal repliées ou agrégées qui peuvent conduire à des anomalies causées par les protéines comme la neurodégénérescence.
Des variantes de ces chaperons sont courantes chez les organismes multicellulaires, mais Hsp104 n'a pas d'homologue chez les humains et les autres animaux. Bien qu'il soit plus robuste que les chaperons d'origine humaine qui peuvent échouer sous le stress cellulaire, Hsp104 a été observé en train de replier des protéines humaines.
"Nous avons fait des expériences où nous avons exprimé des protéines humaines dans la levure, ce qui rend les levures malades car elles s'agrègent. Mais si vous exprimez Hsp104, celui du champignon Calcarisporiella thermophila , il protège la levure de cette maladie d'agrégation, " a déclaré Andrzej Joachimiak, membre distingué d'Argonne.
Joachimiak a travaillé avec une équipe composée de chercheurs d'Argonne, l'Université de Chicago, L'Université de Stanford et l'Université de Pennsylvanie pour mieux comprendre la structure et la fonction de Hsp104.
L'équipe s'est tournée vers la source avancée de photons d'Argonne, une installation utilisateur du DOE Office of Science, pour sonder la structure de la protéine en utilisant la cristallographie aux rayons X. Ils ont examiné 30 échantillons différents, y compris 14 chaperons Hsp104 de différentes sources. Dans ce processus, un monocristal a été plongé dans de l'azote liquide et soumis à des rayons X durs à partir desquels des diagrammes de diffraction ont été collectés et la structure reconstruite. Seule la protéine du Calcarissporiella champignon diffracté à haute résolution, a noté Joachimiak.
Pour mieux comprendre la relation structurelle de la protéine au sein d'une cellule vivante, ils se sont ensuite tournés vers une étude de la protéine en solution. Les échantillons ont été criblés par microscopie électronique à l'Université de Chicago, puis envoyés à l'Université de Stanford, où les microscopes cryoélectroniques ont collecté les données moléculaires à haute résolution nécessaires pour déterminer la structure grâce à des calculs complexes. Comme pour l'enquête sur le cristal, les Calcarissporiella échantillon fourni la meilleure résolution.
Maintenant armé de la plus haute résolution de Hsp104 à la fois sous forme cristalline et en solution, l'équipe a pu faire des déterminations auparavant inconnues ou incertaines sur les caractéristiques et les comportements de la protéine.
Avant la découverte de l'équipe, les biologistes pensaient que Hsp104 soutenait cinq domaines, sections indépendantes de la protéine qui remplissent des fonctions spécifiques. Mais les nouvelles structures haute-fidélité n'ont pas seulement révélé quatre domaines, mais une image plus claire de la façon dont ils se rapportent les uns aux autres.
Le domaine N terminal, par exemple, est censé se lier à une protéine mal repliée et l'aider à se déployer sous une forme linéaire. Cela lui permet de traverser un étroit canal central dans l'hexamère créé par deux domaines AAA (ATPases Associated with diverses cellular Activities). La protéine est guidée, ou déplacé, à travers ce canal de l'autre côté de l'hexamère, où il a maintenant une nouvelle opportunité de se plier correctement.
"Les gens prétendaient auparavant qu'un autre, le domaine C terminal, était essentiel pour la formation de l'hexamère, mais nous avons montré que ce n'est pas vrai, " dit Joachimiak. ?"Il n'interagit pas avec les autres sous-unités, mais peut fonctionner comme une zone d'accueil pour d'autres chaperons pour aider à replier les protéines."
Une autre découverte clé a aidé à renverser une croyance de longue date selon laquelle les hexamères de Hsp104 étaient plats. Les deux méthodes d'investigation ont prouvé sans équivoque qu'elles sont hélicoïdales, aider les chercheurs à comprendre comment le chaperon forme le canal ? « réparation ».
L'équipe prévoit de poursuivre l'exploration des nombreux et variés chaperons qui existent en dehors du génome humain. Ils croient que ces chaperons peuvent servir de stratégie thérapeutique avec le potentiel de démêler littéralement les protéines qui peuvent conduire à une maladie grave.
"Il est possible qu'il y ait d'autres chaperons qui soient meilleurs que les nôtres, et qu'ils seront capables de traiter les protéines qui s'agrègent dans le cerveau et provoquent des maladies, " dit Joachimiak. ?" Ce serait vraiment fantastique."
Le papier, "Structure de Calcarisporiella thermophila Hsp104 désagrégeant qui antagonise divers événements de mauvais repliement protéotoxique, " apparaît dans le numéro en ligne du 27 décembre de la revue Structure . En plus de Joachimiak, La chercheuse d'Argonne, Karolina Michalska, a contribué à cette étude.